Son yıllarda yapılan çalışmalar
21,22, koroner arter hastalıkları için geleneksel risk faktörlerinin (sigara içimi, alkol, diyabet, kolesterol, tansiyon vb.) dışında vasküler hastalıkların patolojisinde rol oynayan beslenme ve biyokimyasal faktörler (diyetteki antioksidanlar ve plazma homosistein miktarı) üzerinde yoğunlaşmıştır. Homosistein, koroner arter hastalıkları ve periferal vasküler hastalıklar için göz önünde bulundurulması gereken önemli ve bağımsız bir risk faktörüdür. Kalp-damar hastalıkların gelişiminde plazma homosistein derişiminin yükselmesinin etkili olduğu genel bir anlayış olarak benimsenmiştir. Kesin olmamakla birlikte homosisteinin patolojik etkileri vasküler lezyonlara sebep olması şeklinde gösterilebilir. Vasküler hastalık ölüm ve hastalıkların oluşumunda en önemli risk faktörleridir. Sigara içimi, hiperkolesterolemi, hipertansiyon ve diyabet vasküler hastalıkların oluşumunda etkili risk faktörleridir. Yüksek homosistein düzeyleri periferal, koroner ve serebrovasküler hastalıklar için bir başka risk faktörü olarak son zamanlarda belirlenmiştir
23,24.
Östrojenin plazma homosisteinini farklı yollarla etkilediği belirtilmiş fakat yine de plazma homosistein derişimi üzerine östrojenin etkisi tam olarak açıklanamamıştır 25,26. Dimitrova ve ark. 27 erkek ratlar üzerinde yapmış oldukları bir çalışmada östrojen uygulamalarının total plazma homosistein derişimini düşürdüğünü ve yine aynı çalışmada diyetlerinde homosistein bulunan ratların endotelyal değişimlere (damar endotelinin kalınlaşması ve hücre infiltrasyonu gibi) uğradığı bildirilmiştir. Diyetlerinde homosistein bulunan ratların miyokardyal GSH düzeyinin önemli derecede azaldığı ve doza bağlı olarak östrojen uygulamalarının miyokardyal GSH miktarını artırdığı bildirilmiştir. Kim ve ark. 28, kortizol ve östrojenin karaciğer ve böbrekteki enzim aktivitelerini etkileyerek plazma homosistein derişimini düşürdüğünü bildirmişlerdir.
Bu araştırmada tüm gruplar incelendiğinde dişi ratların plazma homosistein değerlerinin bütün gruplarda erkek ratlardan anlamlı derecede düşük bulunduğu görülmektedir. Bu çalışmada dişilerde plazma homosistein düzeyinin erkeklerinkine oranla düşük bulunması östrojenin total plazma homosisteinini düşürücü etkisinin olduğunu belirten literatür bilgilerle paralellik göstermektedir 27.
Çalışmalar, melatoninin güçlü bir antioksidan olduğunu göstermiştir 10,29. Melatonin serbest radikallerin ve reaktif türlerinin direkt temizleyicisidir. Diğer yandan melatonin glutasyon peroksidaz (GSH-Px), glutasyon redüktaz (GSSG-Rd), süperoksit dismutaz (SOD) ve katalaz gibi çeşitli antioksidan enzimlerin uyarıcısıdır 10. Serbest radikallerin anormal üretimi protein, lipit ve nükleik asitleri etkileyerek bazı makro moleküllerin yıkımlanmasına yol açarak birçok hastalığın temelini oluşturur. Normal şartlar altında serbest radikallerin oluşturacağı zararlı etkiler hücresel koruma sistemi ile kontrol edilmektedir. Bu koruyucu sistemler melatonin, vitamin E, Vitamin C ve glutasyon gibi enzimatik veya enzimatik olmayan mekanizmalar aracılığı ile etkilerini göstermektedirler 10.
Baydaş ve ark. 10 pinealektomize edilen ratların dokularında lipit peroksidasyon düzeyleri, glutasyon peroksidaz aktivitesi ve okside glutasyon gibi antioksidan enzimlerin günlük değişimlerini incelemişler ve hem ekzojen hem de endojen melatoninin antioksidan enzim aktivitesini artırdığını saptamışlardır. Bu enzimlerin bir kısmının melatoninin sirkadiyan ritmi ile paralellik gösterdiği ve pinealektomize ratlarda bu ritmin etkilendiği belirtilmiştir. Çalışmamızda; homosistein ile birlikte melatonin uygulanan gruptaki ratların plazma SOD, GSH, GSH-Px, katalaz değerleri incelendiğinde kontrol ve homosistein grubu ratlardan yüksek olduğu belirlenmiştir. Bulgularımız, melatoninin direkt antioksidan enzimleri uyarıcı etkisiyle antioksidan özelliği gösterdiğini belirten literatür bildirimleriyle uygunluk göstermektedir 10,29.
Melatonin, lipoik asit ve E vitamini ile plazma MDA düzeyleri arasında negatif bir ilişki bulunmaktadır 30. Serafinowicz ve ark. 31, hiperhomosisteinemik ratlarda lipit peroksidasyon ürünlerinin ve karotit intimal media kalınlığının artmış olduğunu belirtmişlerdir. Cavalca ve ark. 32, plazma homosistein ve plazma MDA artışının kalp-damar hastalıkları ile birlikte olduğunu bildirmişlerdir. Çalışmamızdaki tüm grupların plazma ve doku MDA değerleri incelendiğinde; sadece homosistein uygulanan ratların plazma MDA değerlerinin, kontrol grubuna göre anlamlı şekilde arttığı görülmüştür. Bu sonuç, artan homosistein miktarının, lipit peroksidasyon oluşumunu önleyen ve antioksidan enzimlerden biri olan GSH-Px'in aktivitesini azaltarak oluşturduğu görüşünü destekler niteliktedir 32.
Gilad ve ark. 33, homosisteinin hem GSH-Px aktivitesini inhibe ettiğini hem de bu enzimin m-RNA' sını önemli düzeyde azalttığını bildirmişlerdir. Ovrebo ve Svardal 34, ratlarda plazma homosistein miktarı ile plazma sistein ve glutatyon konsantrasyonu arasında negatif bir ilişkinin var olduğunu belirtmişlerdir. Dayal ve ark. 35, yüksek miktarda metiyonin içeren diyetle beslenen farelerde toplam plazma homosistein düzeyinin kontrol grubuna göre yüksek olduğunu ve glutasyon peroksidaz yetersizliğinin oluştuğunu bildirmişlerdir.
Bu çalışmada homosistein uygulanan erkek ratların hem plazma hem de doku GSH düzeylerinde kontrol grubuna göre azalma tespit edilirken, melatonin uygulamasının ise homosistein grubunda görülen bu azalmaları derinleştirdiği görülmüştür. Ancak dişilerde homosistein uygulaması sadece doku GSH düzeylerinde bir azalmaya neden olmuştur. Bu araştırmada, homosistein uygulanan erkek ve dişi ratların plazma ve doku GSH-Px değerlerinin kontrol grubuna göre düşük olduğu, ayrıca homosistein ile birlikte melatonin uygulanan gruptaki ratların plazma ve doku GSH-Px değerlerinin, kontrol ve homosistein grubu ratlardan daha yüksek olduğu ve literatür bildirimleri 33-35 ile benzerlik gösterdiği anlaşılmaktadır.
Homosistein, SOD' ın endotell hücre yüzeyine bağlanmasını sağlayan endotel heparan sülfat proteoglikanını bozarak arteriyel endotel hücre yüzeyine SOD'ın bağlanmasını engellemektedir. Yüksek miktarda homosistein fibroblastarca ortama verilen SOD basımını azaltmaktadır. Böylece homosistein, endotel hücrelerinin özellikle süperoksit radikali olmak üzere serbest radikallere karşı savunma yeteneğini azaltmaktadır 36. Mevcut çalışmada grupların plazma SOD ve CAT değerleri incelendiğinde; homosistein uygulanan ratların plazma SOD ve CAT değerleri, kontrol ve melatonin grubu ratların plazma SOD ve CAT değerlerinden düşük bulunmuştur. Elde edilen değerler homosisteinin plazma SOD ve CAT aktiviteini azalttığı ve melatoninin de bu azalmaları derinleştirdiği yönündeki literatür bildirimiyle 10,36 paralellik göstermektedir.
Periton içi homosistein uygulamaları karotid arterlerde intimal hiperplaziye ve hücre proliferasyonuna sebep olmaktadır 37. Plazma toplam homosistein miktarları ile karotid arterlerin duvar kalınlığı arasında pozitif bir ilişkinin var olduğu bildirilmektedir 38. Rasyonlarında fazla miktarda metiyonin bulunan tavşanlar üzerinde yapılan bir çalışmada 39, aterosikleroz riskinin ve lipit peroksidasyonun artmış olduğu ayrıca antioksidan enzimlerin etkinliğinde düzensizlikler tespit edilmiştir. Farhat ve ark. 40 hiperhomosisteinemili ratlarda oluşmuş olan aterosiklerotik lezyonlara karşı östrojen uygulamalarının koruyucu etkilerinin olduğunu bildirmişlerdir.
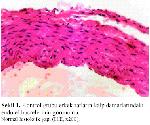
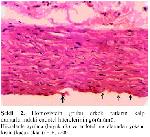
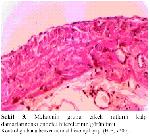
Bu çalışmada kalp damarlarının histolojik kesitleri incelendiğinde kontrol grubuna nazaran homosistein uygulaması yapılmış olan erkek ratların kalp damar endotel hücrelerinin yer yer deskuamasyona uğradığı ve endotel hücrelerinden yoksun kısımların oluşumuyla karakterize erken dönemde aterosiklerozisin şekillendiği dikkati çekmektedir. Melatonin uygulaması ise homosistein grubu erkek ratların damar endotellerinde gözlenen patolojik durumları düzeltmiş olup kontrol grubunun damar endotel yapısına benzer duruma getirmiştir. Bu bulgular homosisteinin kalp damarları üzerine olumsuz yönde etkilerinin olduğunu belirten literatür bildirimleriyle 37-40 paralellik göstermektedir. Ayrıca bu araştırmada homosistein uygulamasının dişi ratların damar morfolojisinde herhangi bir patolojik lezyona neden olmadığı tespit edilmiştir. Bu durum östrojenin damar endotellerinde lezyonların oluşmasına yol açan homosisteini baskılaması 40 ile izah edilebilir.
Sonuç olarak; homosisteinin lipit peroksidasyon ürünlerini (MDA) artırdığı, plazma ve dokulardaki antioksidan enzim aktivitelerinde ise azaltıcı bir etki gösterdiği ayrıca kalp damarlarında dejeneratif değişiklikler oluşturduğu tespit edilmiştir. Antioksidan bir madde olan melatonin ise lipit peroksidasyon ürünleri üzerine baskılayıcı bir etki gösterdiği ve antioksidan enzim aktivitesini artırdığı, ayrıca kalp damarlarında oluşabilecek dejeneratif değişiklikleri önleyebileceği kanaatine varılmıştır.