Kimyasal analizi yapılacak plazma, serum, idrar gibi biyolojik; su, toprak, hava gibi çevresel ve gıda, farmasotik ürünler gibi diğer numuneler, genellikle aranan madde dışında birçok bileşenin yer aldığı karışık bir matriks içerirler. Bu nedenle örnek hazırlama; özellikle yüksek basınçlı sıvı kromatografi (HPLC), gaz kromatografi (GC), gaz kromatografi-kütle spektrofotometresi (GC-MS), radioimmun assay (RIA), atomik absorbsiyon (AA) gibi cihazlar yardımıyla yapılan analizler öncesinde uygulanması gereken çok önemli bir basamaktır
1,2.
Örnek hazırlama başlıca iki amaç için yapılmaktadır. Bunlar sırasıyla, örneklerin istenmeyen bileşenlerden temizlenmesi (clean-up) ve yoğunlaştırılmasıdır. Temizleme işlemi ile matriksten analizin yanlış sonuçlanmasına neden olabilecek, aranan maddenin tespit edilmesini engelleyebilecek veya analiz cihazlarının kirlenmesine neden olabilecek kirliliklerin (impurity) uzaklaştırılması sağlanır 1-3.
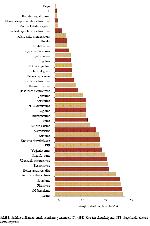
Analiz öncesi yapılması gereken örnek hazırlama, çoğu zaman zor, pahalı ve uzun süren bir işlemdir. Yıllardan beri en sık kullanılan örnek hazırlama yöntemi olan sıvı-sıvı ekstraksiyon yöntemi, fazla miktarda çözücü harcanması, ekstraksiyon sırasında emülsiyon faz oluşması, gerekli saflığa sahip olmayan ekstraktlar elde edilmesi, çözücülerin yeterince uzaklaştırılamaması ve duyarlı kantitatif sonuçlar elde edilememesi gibi istenmeyen durumlara da neden olabilmektedir. Bu nedenle kimyasal analiz yapan kişiler her zaman daha pratik ve basit yöntem arayışı içindedirler 1,2,4. Bu konuda, özellikle kromatografik sistemlerle çalışan 152 araştırıcı ve uygulayıcı ile yapılan bir anket çalışmasında, örnek hazırlama yönteminin seçiminde numunenin özelliği başlıca etken olmakla birlikte, kolay uygulanabilir ve ucuz olmasının da önemli rol oynadığı belirlenmiştir 5. Yapılan araştırmada ankete katılanlar tarafından kullanılan 39 farklı örnek hazırlama yöntemi olduğu tespit edilmiştir (Şekil 1). Ancak kromatografik analizler öncesinde genellikle tek bir örnek hazırlama tekniği yeterli olmamakta, bu yöntemlerden birden fazlası kullanılması gerekmektedir. Klasik olarak analizden önce, sıvı-sıvı ekstraksiyonu, bunu takiben evaporasyon ve uygun çözücünün eklenerek tekrar seyreltilmesi işlemleri bir arada uygulanmaktadır 5.
Büyütmek İçin Tıklayın |
Şekil 1: Sıklıkla kullanılan örnek hazırlama yöntemleri 5. (SPE: Katı faz ekstraksiyonu, SFE: Süperkritik akışkan ekstraksiyonu). |
Örnek hazırlama işleminin basitleştirilmesi, zaman kaybının önlenmesi ve analiz maliyetinin azaltılması amacıyla, 1970'li yılların ortalarında klasik metotlara alternatif olarak yeni bir teknik olan katı faz ekstraksiyon metodu (solid phase extraction, SPE) kullanılmaya başlanmıştır 2,6,7. Günümüzde en etkili örnek hazırlama yöntemlerinden olan SPE, özellikle ilaç ve diğer farmasotik maddelerin analizinde en fazla kullanılan yöntemlerin başında gelmektedir 3,8,9.
GENEL ÖZELLİKLERİ ile KATI FAZ EKSTRAKSİYONU (SOLID PHASE EXTRACTION, SPE) METODU
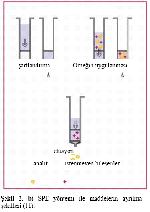
SPE yöntemi, temel olarak küçük, tek kullanımlık ekstraksiyon kolon veya disklerine çeşitli tutucu maddelerin doldurulması ve sıvı örneklerini istenmeyen bileşenlerden ayırma (temizleme), yoğunlaştırma ve ileriki analiz aşamaları için örnek matriks yapısının değiştirilmesi amaçlarıyla hazırlanmış olan kolon ve disklerden geçirilmesi esasına dayanmaktadır. Sıvı örneğin kolondan geçirilmesi, yerçekimi vasıtasıyla (manual) gerçekleştirilebildiği gibi, zaman kaybının önüne geçmek amacıyla vakum manifoldları yardımıyla da yapılabilir. Son yıllarda aynı prensiple çok daha düşük miktarda örneğin uygulandığı çok sayıda kuyucuk (genelde 96) içeren SPE plakaları da kullanılmaktadır 1,2,8,10,11. Şekil 2'de klasik bir SPE kolonunun yapısı, çeşitli ticari SPE kolon, disk ve plakaları ile vakum pompa ve manifoldlu süzme düzeneği görülmektedir.

Büyütmek İçin Tıklayın |
Şekil 2: a) SPE kolonunun yapısı 12 d. Vakum manifoldu.
Şekil 2. b) SPE mikroplakaları 13
Şekil 2. c) Çeşitli ticari SPE kolon ve diskleri 14
Şekil 2. d) Vakum manifoldu. |
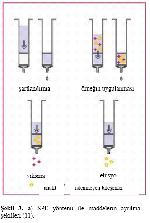
SPE metodunda kolondan geçirilme sırasında örnek molekülleri ile tutucu madde arasında kimyasal bir etkileşim meydana gelir. Bu etkileşimden faydalanarak maddelerin ayrılma işlemi başlıca iki yolla gerçekleştirilir. Birinci yöntemde ilk aşamada, analiz edilecek bileşik tutucu maddeye bağlanarak kolon içinde tutulurken, çözelti ve istenmeyen bileşenler bu madde ile herhangi bir etkileşime girmezler. Daha sonra istenmeyen bileşenler uygun yıkama çözeltisi ile uzaklaştırılır ve analiz edilecek bileşen tutucu maddeden uygun bir çözelti yardımıyla çözdürülerek alınır (Şekil 3-a). Daha az tercih edilen ikinci yöntemde ise, istenmeyen bileşenlerin tutucu madde ile etkileşimi sözkonusudur. Özellikle atık yağlar gibi matriksden ayrılması zor olan maddelerin analizinde kullanılan bu yöntemde, matriksteki istenmeyen bileşenler tutucu madde tarafından sıkı şekilde bağlanırlar. Asıl aranan madde ise tutucu madde ile etkileşime girmez ve uygun çözelti yardımıyla çözdürülerek toplanır. Bu yöntemde, kolon içerisindeki tutucu maddenin oluşturduğu katı faz filtre işlevi görmektedir (Şekil 3-b) 1,2,11,15.
Şekilde de görüldüğü üzere, her iki ayırma yönteminde de SPE kolondaki tutucu maddenin önce şartlandırılması gerekmektedir. Şartlandırma işlemi, kolondan uygun çözelti geçirilerek tutucu maddenin aktif hale getirilmesi ve matriksteki maddeler ile tekrarlanabilir etkileşim için gerekli ortamın sağlanabilmesi amacıyla yapılmaktadır. Polar olmayan tutucu maddeler, kolon hacminin 2-3 katı miktarda suyla karışabilen metanol, tetrahidrofuran, isopropanol gibi polar çözücüler ile; polar tutucu maddeler ise polar olmayan çözücülerle şartlandırılmaktadır 2,11.
SPE metodunda ayrılma işleminin gerçekleşmesi için tutucu madde ve çözücüler büyük önem taşımaktadır. Tablo 1'de SPE için tutucu kimyasal maddeler (adsorbanlar), Tablo 2'de ise SPE metodunda sıklıkla kullanılan çözücüler görülmektedir.
SPE METODUNDA MADDELERİN AYRILMA PRENSİPLERİ
SPE metodunda maddelerin birbirinden ayrılması, analizi yapılacak maddenin molekülleri ile tutucu maddedeki etkin gruplar arasındaki moleküller arası etkileşimler sayesinde açıklanır. Analizi yapılacak madde molekülleri tutucu maddelerdeki etkin gruplara iyonik, hidrojen, dipol-dipol, dipol-indüklenmiş dipol ve indüklenmiş dipol-indüklenmiş dipol (van der Waals) bağları ile bağlanır. Bu şekilde aranan madde, matriksteki istenmeyen bileşikler ve çözücüler birbirinden ayrılmış olur 2.
SPE metodunda kromatografik yöntemlere benzer şekilde, analiz edilecek madde, çözücü ve tutucu maddelerin özelliklerine göre çeşitli ayırma mekanizmaları rol oynar. Belli başlı ayırma mekanizmaları olarak normal faz, ters faz, iyon değişim (katyonik ve anyonik değişim) ve moleküler eleme (size exclusion) sayılabilir 2,11,16.
Normal faz; polar bileşiklerin polar olmayan matrikslerden ayrılması işlemidir. Şartlandırma aşaması polar olmayan çözücüler, toplama aşaması ise daha polar çözücüler yardımıyla gerçekleştirilir. Bu yöntemde en fazla kullanılan tutucu madde silikadır. Florosil ise pestisitler için en uygun tutucu maddedir. Karbonhidratça zengin bazı aşırı polar örnekler için ise silika, alumina gibi tutucu maddelere çeşitli grupların eklenmesi ile elde edilen siyano, diol ve amino grubu tutucu maddeler tercih edilmektedir. Bu maddelerdeki polar gruplar, polar olmayan organik çözücüler (hekzan/dietileter gibi) içerisindeki orta derecede polar olan örnek moleküllerini tutarlar 2,16.
Ters faz, tutucu madde polaritesinin örnek çözeltisinden daha düşük olduğu sistemdir. Oktadesil (C18) bu teknik için en fazla kullanılan madde olmakla birlikte, oktil (C8), siklohekzil, bütil, fenil ve siyano da çeşitli örnekler için seçici olmaları nedeniyle tercih edilirler. Ters faz, klinik ve çevresel örneklerdeki organik kalıntıların analizinde çok yaygın şekilde kullanılan bir ayrım tekniğidir 2,16.
İyon değişim, özellikle asit ve bazların matriksten elde edilmesi amacıyla kullanılan ve iki molekül arasındaki iyonların karşılıklı değişimi esasına dayanan bir tekniktir. SO3- ve N+(CH3)3 gibi etkin gruplar bağlanmış aşırı polar silika benzeri tutucu maddeler iyon değişim için uygundur. SO3- grubu, örnek çözeltisinden aranan temel maddelerin ayrılması için kuvvetli katyonik değişimi (SCX, strong cation exchanger), N+(CH3)3 grubu ise asitlerin bağlanması için kuvvetli anyonik değişimi (SAX, strong anion exchanger) sağlamaktadır. İyon değişim tekniğinde pH, zıt yüklü olma, iyonik kuvvet, organik çözücünün özelliği ve örneğin kolondan geçiş hızı gibi faktörler önem taşımaktadır. Başarılı bir iyon değişiminin sağlanabilmesi için, tutucu madde ile analiz edilecek maddenin zıt yüklerde olması ve örnek çözeltisindeki zıt iyon yoğunluğunun düşük olması gerekmektedir 2,16.
Moleküler eleme tekniğinde ise dekstran jel gibi maddeler, içerdikleri gözenekler (porlar) sayesinde örnek çözeltisi içerisindeki maddelerin molekül büyüklüklerine göre ayrılmasını sağlar. Örnek çözeltisi içerisindeki molekül ağırlığı 10 000'den düşük maddeler bu gözeneklere girebilirken, daha büyük maddeler direkt kolondan geçer. Böylece büyük maddeler ayrılırken, küçük molekül ağırlıklı maddeler kolonda kalmakta ve bu şekilde ayrım gerçekleşmektedir. Bu teknikte, ideal olarak maddelerin tutulması ya da diğer moleküler etkileşimlerin olmaması istenir. Moleküler eleme, genellikle bağlı olmayan radyoizotopların ve protein çözeltilerinden tuzların ayrılmasında kullanılan bir tekniktir 2.
Karışık matrikslerden analizi yapılacak maddelerin istenilen düzeyde ayrılarak, ideal bir örnek hazırlama basamağının gerçekleştirilmesi için doğru ayrım tekniğinin kullanılması çok önemlidir. Şekil 4'de örneğin özelliğine göre seçilmesi gereken SPE ayrım tekniği gösterilmiştir.

Büyütmek İçin Tıklayın |
Şekil 4: Analiz edilecek örneğin özelliğine göre seçilmesi gereken SPE ayrım tekniği (16). (SCX: strong cation exchanger, kuvvetli katyon değişimi yapan; SAX: strong anion exchanger, kuvvetli anyon değişimi yapan). |
SPE METODUNUN AVANTAJLARI
SPE metodunun diğer örnek hazırlama yöntemlerine, özellikle sıvı-sıvı ekstrakyona kıyasla daha fazla tercih edilmesinin nedenleri ve önemli avantajlı yönleri şu şekilde özetlenebilir:
a- SPE metodu klasik sıvı-sıvı ekstraksiyon yöntemine göre 2/3 daha hızlı sonuç verir ve örnek hazırlama süresinin oldukça kısalmasını sağlar 2,11.
b- SPE, çok pratik ve bütün laboratuvarlarda kolaylıkla uygulanabilir bir metottur 2,17,18.
c- Bu yöntemde daha az çözücü ve ayıraç madde kullanıldığından daha ekonomik bir örnek hazırlama yapılabilir 11.
d- Geri kazanım (recovery) oranı yüksektir ve istenilen yoğunlukta örnekler elde edilebilir. En az düzeyde örnek transferi yapıldığından yüksek geri kazanımlar ile yüksek yoğunluk ve saflıkta örnekler elde edilebilmektedir 1,17,18.
e- Örnek, tutucu madde ve çözücüler arasında çapraz bulaşma riski düşük olduğundan yüksek doğrulukta sonuçlar alınabilir 2,17.
f- Düşük miktarda örnek işlendiğinden sıvı-sıvı ekstraksiyondaki gibi emülsiyon oluşma problemi yoktur 2.
g- SPE metodunda en az düzeyde evaporasyona ihtiyaç duyulduğundan kararsız örnek oluşumu nadirdir 2,17.
h- Çözücü ve örneklerin az miktarlarda kullanılmasından dolayı zehirli maddelerle temas daha azdır ve ayrıca daha az cam malzeme kullanılması nedeniyle analizi yapanlar için oldukça güvenli bir metottur. Ayrıca çevreyi kirletme riski daha düşüktür 17-19.
i- Çok sayıda örneğin aynı anda ve tekrarlanabilir şekilde işlenebilmesine olanak sağlayacak şekilde çok kolay otomasyon sağlanabilir 2,11,19.
SPE METODUNUN BAŞLICA KULLANIM YERLERİ
SPE metodu sahip olduğu avantajlar sayesinde özellikle çevre ve gıda, analitik biyokimya, farmasotik biyoanaliz, toksikoloji ve adli tıp, kozmetik, organik sentez vb. alanlarda günümüzde en fazla kullanılan örnek hazırlama metodlarından birisi haline gelmiştir 2,20. Tablo 3'de belli başlı SPE tutucu maddelerin hangi bileşiklerin analizinde kullanıldığı özetlenmiştir.
Tablo 3'de görüldüğü gibi, SPE bugün birçok farklı özellikteki bileşiklerin kimyasal analizinde tercih edilen bir metottur. Farmakoloji ve toksikoloji bilimleri kapsamında gıda numuneleri; su, toprak gibi çevresel; kan, serum, idrar gibi biyolojik örneklerdeki kirleticiler ile ilaç ve zehir analizleri SPE'nin en önemli kullanım alanlarıdır 3,21-23.
Gıdaların besin madde analizlerinin yanı sıra, içerdikleri kimyasal ve biyolojik kirleticilerin tespit edilmesinde SPE önemli bir örnek hazırlama metodudur. Özellikle fındık gibi mikotoksin kirliliği açısından önem taşıyan gıdalarda başta aflatoksinler ve diğer mikotoksinlerin, hemen hemen bütün bitkisel ve bal, süt, peynir gibi hayvansal gıdalarda ve bebek mamalarında pestisit ve PCB'lerin, et ve et ürünlerinde steroid hormon ve PAH'ların tespit edilmesi, bu alanda SPE metodunun kullanılmasına verilebilecek en önemli örneklerdir 24-28.
SPE çevresel örneklerden en çok sudaki organik kirleticilerin analizinde kullanılmaktadır. Su içerisinde µg/L(ppb) ve daha alt düzeylerde birçok organik kirletici bulunmaktadır ve bu maddelerin saptanabilmesi için çok düşük tespit limitlerine ulaşılması gerekmektedir. SPE metodu, sudaki kirleticilerin analizinde diğer örnek hazırlama yöntemlerine göre daha yoğun ve daha saf süzüntü oluşturabilmesi ve yüksek geri kazanım oranlarına sahip olması nedeniyle tercih edilmektedir. SPE'nin örnek hazırlama amacıyla kullanıldığı su kirleticileri arasında organik klorlu ve organik fosforlu pestisitler, PCB'ler, anilinler, fenolik bileşikler, organik azot ve nitro-aromatik maddeler sayılabilir 6,10,17,19,22.
İdrar, kan, serum, safra, mide içeriği, karaciğer, beyin gibi biyolojik örneklerde ilaç düzeylerinin tespiti günümüzde SPE'nin en önemli kullanım alanlarından birisidir. Bilindiği gibi ilaç geliştirme aşamalarının önemli bir basamağı; ilaç ve metabolitlerinin vücut sıvılarındaki seviyelerinin tespit edilmesidir. Bunun yanında tedavi etkinliğinin takibi amacıyla da biyolojik örneklerde ilaç miktarının analizi önem taşımaktadır. Özellikle yüksek geri kazanımlara sahip olması, daha saf süzüntüler elde edilebilmesi ve çok sayıda örneğin kısa zamanda işlenmesine olanak verecek şekilde otomasyon sağlayabilmesi nedeniyle hemen hemen bütün ilaç ve benzeri maddelerin analizinde SPE yaygın olarak kullanılmaktadır. Bunun yanısıra son yıllarda pek çok tıbbi bitkinin ekstraksiyonunda da SPE yaygın olarak kullanılan bir yöntem haline gelmiştir 15,29,30.
Zehirlenmelerde zehirleyici madde ile amaç dışı kullanılan opiat, kokain, amfetamin gibi ilaç ve diğer maddelerin belirlenebilmesi için bunların vücut sıvılarında tespit edilmesi gerekmektedir. Bu tip analizler, tam olarak ne arandığının bilinememesi ve aranan maddelerin fiziksel ve kimyasal özelliklerinin aşırı değişkenlik göstermesi nedeniyle oldukça zahmetli ve zaman alıcıdır. SPE metodu, diğer örnek hazırlama yöntemlerine göre sahip olduğu avantajların yanında özellikle polar, polar olmayan yapıda ve asidik, bazik veya nötral özellikte hemen her tür maddeye uygun tutucu maddeler bulunması nedeniyle toksikolojik analizlerde en fazla tercih edilen örnek hazırlama yöntemidir 21,23.
SPE METODUNDA YENİ EĞİLİMLER ve SPE'NİN GELECEĞİ
İdeal bir SPE metodunun, asidik, bazik ve nötral maddeler için yüksek geri kazanım oranlarına sahip olması, ilaç ve metabolitlerinin biyolojik sıvılarda pg/mL düzeyinde izole edilebilmesine olanak vermesi, büyük hacimli örnekler için kolay otomasyon sağlayabilmesi, hızlı ve düşük maliyetli olması istenir 1. Bu ideal koşulların elde edilebilmesi amacıyla; SPE materyal şekilleri, tutucu madde, otomasyon teknikleri ve yeni SPE prosedür yaklaşımları sürekli geliştirilmektedir 8,20.
SPE metodu kullanılmaya başlandıktan kısa bir süre sonra, 1978 yılında tek kullanımlık kartuşlara geçilmiş; bugünkü şırınga tipi kolonlar ise ilk olarak 1979 yılında kullanılmıştır. Bu tip kolonlar günümüzde de en popüler SPE ekipmanıdır ve son yıllarda yoğun olarak otomatik kontrol edilebilir hale getirilmeye çalışılmaktadır. Genel bir kural olarak, SPE kolonları daha temiz bir süzüntü elde edilebilmesi için medikal özellikte polipropilen ve polietilen materyalden imal edilmektedir. Kolonların en önemli dezavantajı örnek akış hızının düşük olması ve özellikle yüzey ve atık su analizlerinde bir ön filtrasyon işlemine ihtiyaç duyulmasıdır. Bu dezavantajların ortadan kaldırılması amacıyla son yıllarda diatoma toprağı (diatomaceous earth) içeren derin filtreler bir hücre şeklinde kolonlara entegre edilmektedir. Bu maddenin özel seçici geçirgenliği sayesinde hem ön filtrasyona gerek kalmamakta hem de akış hızı yükselmektedir 8,17.
İkinci en popüler şekil ise SPE diskleridir. SPE diskleri geniş süzülme alanları ve ince yapıları sayesinde yüksek örnek akış hızlarına sahiptir. Ancak örnekteki süspanse haldeki maddelerin geçmesi çok zor olduğundan klasik disklerde iyi bir ayrım her zaman sağlanamayabilir. Bu nedenle mikrofiber yapıda tutucu madde eklenmiş özel diskler imal edilmiştir. Bunun yanında kolonlardakilere benzer şekilde çok ince derin filtre içeren yeni diskler de mevcuttur ve bu disklerle 1 L yüzey suyu örneği, 5 dakikadan daha az sürede filtre edilebilmektedir 8.
Ayrıca 1990'lı yılların sonlarına doğru özellikle ilaç ve metabolitlerinin analizlerinde olduğu gibi az miktarda numune kullanılarak çok miktarda örnek işlenmesinin gerektiği durumlarda son derece faydalı olan, yeni bir disk şekli kullanıma girmiş ve giderek yaygınlaşmıştır. Bu teknoloji ilk olarak 1997 yılında 96 kuyucuklu SPE plakalarının kullanılmaya başlanması ile ortaya çıkmıştır. Bu plakalar sayesinde 100-200 µL örnek çözeltisi toplanabilmektedir. Daha sonraki yıllarda bu plakalarda bulunan kuyucuklara SPE pipetlerinin eklenmesi ile kolaylıkla otomatize edilme imkanı da sağlanmıştır 8,30.
Bir diğer düşük hacimli SPE formatı ise gaz veya sıvı kromatografi sistemlerine doğrudan monte edilebilen mikrofiberlerdir. Bu teknoloji Pawliszyn ve arkadaşları tarafından 1980'li yılların sonunda geliştirilmiş ve 1992 yılında ticari olarak piyasaya sunulmuştur 8. “Katı Faz Mikro Ekstraksiyonu (Solid Phase Microextraction-SPME)” adı verilen bu yöntem son birkaç yılda oldukça popüler hale gelmiştir. SPME, gaz veya sıvı kromatografi sistemlerine monte haldeki kapalı vial veya headspace ünitelerine doğrudan konulmuş sıvı veya gaz örneklerden, aranan maddelerin çok küçük partiküllü silika elyaf yardımıyla ayrılması tekniğidir. Aslında çevresel örneklerdeki uçucu maddelerin ekstraksiyonu için geliştirilmiş olan bu yöntem, çözücüye ihtiyaç duyulmaması, bütün örnek hazırlama aşamalarının bir arada yapılabilmesi ve çok daha hassas ayırım yapılabilmesi nedeniyle son derece kullanışlı ve güvenilirdir. Bu nedenle önümüzdeki yıllarda da klasik SPE kadar yaygın olacağı öngörülmektedir 8,9,31-34.
Otomasyonun SPE metodunda ilk olarak kullanıldığı 1989'dan günümüze kadar özellikle çevre ve gıda bilimleri, klinik ve analitik biyokimya, farmasotik biyoanaliz ve adli tıp alanlarında otomatik (on-line) SPE sistemleri yaygın şekilde kullanılmaktadır. Klasik olarak 24 numunenin ekstraksiyonu aynı anda negatif veya pozitif basınç altında SPE'nin tipik aşamaları ile gerçekleştirilebilirken, bugün bütün aşamaların otomatik şekilde programlanarak yapılabildiği sistemler de mevcuttur 8,20,28.
SPE metodunda tutucu maddelerdeki gelişmeler sayesinde çok geniş bir polarite spektrumundaki maddelerin ayrımı kolaylıkla yapılabilmektedir. Yeni tutucu maddeler arasında bulunan monofonksiyonel C18 silika ve buna benzer maddelerde, silika yüzeyindeki modifiye olmamış silanol grupları artırılmış, böylece analiz edilecek madde çözeltisi ile meydana gelebilecek ikincil etkileşimlerin azaltılması sağlanarak daha iyi bir ayrım gerçekleşmesi temin edilmiştir. Çevresel su analizlerinde karşılaşılan polar maddelerin ekstraksiyon problemleri ise karbon bazlı ve sitren-divinilbenzen gibi yeni tutucu madeler kullanılarak azaltılmıştır. Bu maddelerle ilgili önemli bir problem de, ekstraksiyondan önce şartlandırma gerekmesi ve tutucu maddenin bazen yeterince şartlandırma çözeltisiyle temas edememesidir. Bunu önlemek için geliştirilmiş yeni kuşak polimer tutucu maddelerin şartlandırılmasına gerek yoktur ve bunlar lipofilik, hidrofilik, asidik, bazik ve nötral özellikteki birçok maddenin aynı tip kolon yardımıyla ekstraksiyonuna olanak tanımaktadır 8,15.
SPE metodunda, zaman zaman tutucu maddelerin analiz edilecek bileşik için yeterli seçiciliğe sahip olmaması sorunu yaşanabilmektedir. Özellikle C18 ile iyon değişim ve moleküler eleme tekniklerinde kullanılan diğer geleneksel SPE tutucu madde ve ortamları, çok düşük düzeyde kalıntı analizlerinde aranan maddeler için yeterli seçiciliğe sahip değildir. Bu yüzden matriksteki istenmeyen bileşikler analiz edilecek madde çözeltisine karışmakta ve istenilen saflıkta bir süzüntü elde edilememektedir. Bu sakıncanın ortadan kaldırılması amacıyla, bir çok SPE tututucularına hedef maddeye spesifik bileşenler eklenmiş ve seçicilikleri arttırılmıştır. Tutucu maddelere eklenen bu özel maddeler arasında boronat, lektin, protein A ve G, sabit metal iyonları, peptidler ve antikorlar sayılabilir. Özellikle antikorlar, bileşik ya da grup spesifik adsorbanlar (immunosorbanlar) elde edilmesine olanak sağlamakta ve dayanıklı olmayan biyolojik örneklerde başarılı sonuçlar alınmaktadır. Aynı zamanda bu tutucu maddeler sayesinde ekstraksiyon, yoğunlaştırma ve izolasyon tek basamakta gerçekleştirilebilmektedir 3,8,15,35.
Örnek hazırlama prosedürlerinin gelişiminde ise örnek hazırlama basamağını mümkün olduğunca basitleştiren, ekstraksiyon ve temizleme basamaklarının bir arada yapılabilmesine olanak sağlayan, bunun yanında özellikle çevresel örnek analizlerinde bir çok madde kalıntısını aynı anda ekstrakte ve analiz etmeye (çoklu kalıntı metodu) yönelik prosedür geliştirme çalışmaları dikkat çekmektedir 7-9.