Çalışmamızda ortaya çıkan ana sonuçlar şunlardır:
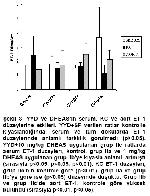
1 YYD ile beslenme ratlarda hipertrigliseridemi ve hiperkolesterolemi yaratmaktadır.
2 Düşük ve yüksek dozlarda DHEAS, TG ve TK düzeylerini düşürmektedir.
3 YYD, serum ve KC leptin seviyelerini arttırmaktadır.
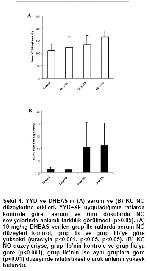
4 YYD, ET-1, NO ve VEGF parametreleri üzerinden endotel fonksiyonuna etki göstermemektedir.
5 Yüksek doz DHEAS uygulanmasıyla serum ET-1 ve NO seviyeleri eş zamanlı artmaktadır.
6 Ne YYD, ne de DHEAS kullanımının VEGF düzeylerine herhangi bir etkisi bulunmamaktadır.
Literatürde ratlara 4 hafta ve hatta daha kısa süre ile YYD verilmesinin hipertrigliseridemiye yol açtığı bildirilmiştir 33-35. Başka bir çalışmadaysa, bu sonuçlara zıt olarak, 8 hafta YYD verilen ratlarda yüksek TK ancak normal TG düzeyleri gösterilmiştir 36. Çalışmamızda 20 haftalık YYD, 11 ve 24 hafta boyunca YYD verilen ratlarda olduğu gibi 4,5, TG ve de TK düzeylerinde anlamlı artışa neden oldu. DHEAS uygulanmasıyla, YYD'in serum TG ve TK düzeylerinde yarattığı bu yükselmeler doza-bağımlı olarak azaldı. Bu sonuçları destekleyen başka yayınlarda da, DHEAS'ın ratlarda TG ve TK düzeylerini düşürdüğü bildirilmiştir 26,37. 6 hafta boyunca içme suyunda verilen 0.8 mg/kg DHEAS Osborne-Mendel ratlarda karkas lipid, yağ deposu kitlesi ve retroperitoneal ve epididimal adiposit sayısını azaltmıştır 37. YYD ile beslenen maymunlarda DHEA'nın kolesterol düzeylerini düşürmediği bildirilse de 38, DHEA'nın plazma TG ve TK düzeylerini düşürdüğüne dair yayınlar da mevcuttur 26,39. DHEA'nın –muhtemelen DHEAS'ın- lipoprotein lipaz aktivitesini arttırarak lipid-düzeylerini düşürdüğü ve bu mekanizma sonucunda anti-obeziter etki gösterdiği öne sürülmektedir 28. DHEAS'ın dokularda testosteron veya östradiol gibi çok daha aktif seks steroidlerine dönüştürülüp, androjen veya östrojen reseptörlerine bağlanarak etki göstermesi TG ve TK düzeylerini azaltmasında alternatif bir mekanizma olabilir 29. Deneysel çalışmalar, aksi yönde bilgi olsa da 4, YYD ile beslenmenin HDL-K düzeylerini arttırdığı yönündedir 35,40. Bu çalışmada da, bu çalışmalara paralel, YYD'in -istatistiksel açıdan anlamlı değilse de- HDL-K düzeylerini ~% 20 arttırdığı tespit edildi. Ancak, YYD ile indüklenen HDL-K 1 mg/kg DHEAS ile ~% 7 oranında azalırken, 10 mg/kg DHEAS ile ~% 13.8 azalarak standart diyetle beslenen ratlardaki seviyelere geriledi. HDL-K'daki bu düşüşten yola çıkarak, DHEAS'ın TK seviyelerini azaltırken selektif etki göstermediğini, TK seviyelerindeki kadar belirgin olmasa da HDL-K düzeylerini de azaltarak kolesterol metabolizmasını tek yönde etkilediğini düşünmek mümkündür.
YYD ile beslenerek obez yapılan sıçanlarda leptin düzeyleri yüksektir 41-45. Aksine, 4 haftalık YYD'in leptin düzeylerini standart diyetle beslenen ratlara göre anlamlı azalttığı da bildirilmiştir 46. Ancak, aynı çalışmada beslenme süresi 14 haftaya tamamlandığında leptin düzeyleri artmıştır 46. Bu rapordan da anlaşılacağı üzere, YYD ile beslenen ratlardaki leptin düzeyleri beslenme süresiyle doğrudan ilişkilidir. Bu araştırmada 20 hafta boyunca verilen YYD, serum ve KC leptin seviyelerini arttırdı. Bu durumun altında yatan olası mekanizma, YYD sonucu gelişen adipoz dokudan leptin sekresyonunun artışıdır 47,48. Araştırmamızda, YYD'in rat vücut ağırlıklarında herhangi bir artışa yol açmadan, hiperleptinemi oluşturması da bu hipotezi desteklemektedir. DHEAS'ın leptin üzerine etkileri toplu olarak değerlendirildiğinde serum leptin düzeylerini minimal azaltıp, KC leptin düzeylerini bir miktar yükselttiği ama bu yüksekliklerin anlamlı olmadığı tespit edildi. Aort leptin düzeyleri YYD ve 1 mg/kg DHEAS verilmesiyle, serum ve KC'dekinin aksine azaldı. Ancak 10 mg/kg DHEAS ile aort leptin seviyeleri tekrar kontrol grubu seviyelerini buldu. Bu bulgular, DHEAS'ın sözkonusu anti-obeziter etkilerinin 28,29 leptin salınımından bağımsız gelişebileceği ihtimalini ortaya koymaktadır.
YYD, direkt olarak endotel fonksiyonunu hasarlamaktadır 6-8,49. YYD ile beslenen farelerde serum ET-1 ve leptin, miyokardial ET-1 ve leptin reseptör mRNA düzeyleri artmıştır 41. Kolesterolden zengin diyet verilen ratlarda, indüklenebilir nitrik oksid sentetaz (iNOS) ve ET-1 seviyeleri eş zamanlı yükselmektedir 50. 2007 yılında yapılan bir çalışmada 12 hafta YYD ile beslenen domuzlarda, hiperleptinemiye eşlik eden azalmış koroner endotelyum-bağımlı vazorelaksasyon ve artmış miyokardial mikrovasküler permeabilite bildirilmiştir 51. Bu sonuçlar, YYD'in yüksek leptin düzeyleri ile ilişkili, artmış vasküler oksidatif stres ve endotelyal disfonksiyona neden olduğunu göstermektedir. Bütün bu raporların aksine -ve de eşlik eden hiperleptinemiye rağmen- YYD+SF uygulanan ratlarda, standart diyetle beslenenlere göre serum ve tüm dokularda hem ET-1, hem NO açısından istatistiksel düzeyde fark gözlenmedi. Bilinenin aksine tek başına YYD, ET-1, NO ve VEGF üzerinden endotel fonksiyonlarında belirgin bir etki yaratmamıştır. Kardiyovasküler hastalık gelişme riski yüksek postmenapozal kadınlarda, DHEAS'ın plazma ET-1, nitrit ve nitrat seviyelerini değiştirmediği ve endotel-bağımlı vazodilatasyonu etkilemediği tespit edilerek, endotel fonksiyonu üzerine herhangi olumlu etkisi olmadığı iddia edilmiştir 52. Ancak, DHEA'nın –muhtemelen DHEAS'ın da- in vitro NO sentezini arttırarak endotel fonksiyonunu iyileştirebildiği de rapor edilmiştir 53. Bu çalışmada, YYD+10 mg/kg DHEAS uygulanan grupta yüksek serum ET-1 ve NO, KC NO ve aort ET-1 düzeyleri mevcuttu. Aynı grupta aort NO düzeyleri arttıysa da, anlamlı değildi. KC' de ise aynı grupta ET-1 düzeyleri azalmıştı. DHEAS verilmesiyle ET-1 ve NO gibi zıt davranışlı moleküllerin eş zamanlı artışı, endotelyuma etkisinin sadece vazodilatasyon/vazokonstriksiyon mekanizması üzerinden açıklanamayacağı anlamına gelebilir.
Diyetteki yüksek yağ hipertrigliseridemi, hiperkoles-terolemi ve hiperleptinemiye yol açar 4,5,33-35,41-45. Bu araştırmanın bulguları, obezite, koroner arter hastalığı ve metabolik sendrom gibi hastalıklarda ilaç tedavisinin yanı sıra diyetteki yağ miktarının kısıtlanmasının önemini bir kez daha göstermektedir. DHEAS leptin salınımından bağımsız olarak, TG ve TK düzeylerini azaltarak lipid metabolizmasını düzenlemektedir. Bu çalışmada gerek 20 haftalık YYD'in, gerekse düşük ve yüksek doz DHEAS'ın endotel fonksiyonuna etkisini değerlendirmek üzere ölçtüğümüz NO, ET-1 ve VEGF aktivitelerinde herhangi bir farklılık görülmedi. Bu nedenle, YYD'in endotel fonksiyonuna etkisinin çok daha kompleks bir proçes olduğu ve/veya endotel disfonksiyonu değerlendirmek için ek analizlere ihtiyaç olduğu düşünülebilir. Endotelyal hasarı gösteren von Willebrand faktörü (vWF), endotelyal disfonksiyon markırları solubl adezyon molekülleri (ICAM-1 ve VCAM-1), platelet aktivasyonunu değerlendirmede kullanılan P-selektin ve endotel disfonksiyonunu direkt olarak tespit edebilen brachial arter Doppler ultrasonu gibi analizlerin yapılması halinde YYD'in endotel fonksiyonuna etkileri daha iyi anlaşılabilecektir 54-56.
Son olarak, DHEAS'ın anti -obeziter ve ateroskleroz oluşumunu önleyici etkisini TG ve TK düzeylerini düşürerek, lipid metabolizması üzerinde yarattığı olumlu aktiviteyle açıklamak mümkündür. DHEAS'ın, özellikle HDL-K düzeylerini azaltıcı etkisi nedeniyle adeta anti-lipidemik bir ajan/supleman olarak kullanımı sınırlı olabilir. DHEAS'ın bu tür bir amaçla kullanılabilmesi için, öncelikle insan vaka gruplarında yapılacak daha geniş ve daha uzun vadeli çalışmalara gereksinim olduğu açıktır.