Karaciğerde oluşan parankimatöz kanamanın durdurulması için kanamanın nedenine bağlı olarak birçok yöntem denenmiştir
12, 13, 24. Bu amaçla yapılan koterizasyon ve ligatür uygulamaları gibi cerrahi tekniklerin oluşacak hemorajiyi her zaman kontrol edemediği
6, 25 yapılan sık transfüzyonlar sonucunda ise koagülopati oluşabileceği bildirilmiştir.
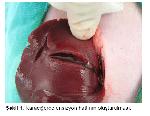
Lokal hemostatik maddelerin çoğunda temel etki mekanizması; trombositlerle temas edip aktivasyona yol açarak doğal hemostaz sağlayıcı mediyatörlerin salgılanmalarını teşvik etmektir. Ayrıca bazı maddelerde tıkaç oluşturma ve yapıştırma gibi yardımcı etki mekanizmaları da mevcuttur 4, 8. Lokal olarak kullanılan siyanoakrilatın kuru yüzeylere uygulama zorunluluğu, yabancı cisim reaksiyonlarına yol açması, sepsisler ile ilişkileri ve kanserojen etki oluşturması yaygın kullanımını kısıtlamıştır 24. Jelatin spanç ve kollojenler çoğu durumlarda genellikle etkisizdirler çünkü bu ajanların hemostatik etkileri yeterli trombosit ve pıhtılaşma faktörlerine bağlıdır. Araştırmacılar 3, 4, 26, 27 fibrin yapıştırıcının doğal hemostatik bir ajan olduğunu ve hemostatik etkisinin hastanın pıhtılaşma profiline bağlı olmadığını belirtmişlerdir. Fibrin yapıştırıcı özellikle otolog olarak hazırlandığında, organizma ve dokularla çok iyi uyum sağlayan, yabancı cisim reaksiyonu oluşturmayan bir maddedir. Uygulandığı dokunun vaskularitesine bağlı olarak, değişen süre içerisinde hiçbir reaksiyona yol açmadan fibrinoliz sonucu tamamen rezorbe edilir 28-30. Yapılan araştırmada tavşan karaciğerinde deneysel olarak standart bir ensizyon (0.5 cm derinliğinde ve 2 cm uzunluğunda) oluşturulmuştur. Karaciğer travmalarında fibrin yapıştırıcı ve dikiş uygulamalarının meydana gelecek kanamaların durdurulması, karaciğer dokusunun iyileşmesi üzerine etkisi ve oluşacak komplikasyonlar makroskopik ve histopatolojik olarak değerlendirilmiştir. F grubunda operasyon ortalama 21 dak da D grubunda ise ortalama 30 dak. da tamamlanmıştır. Yine F grubunda kanama ortalama olarak 80 sn de dururken D grubunda 227 sn de durmuştur. Her iki grupta tespit edilen klinik, biyokimyasal ve histopatolojik bulgular göz önüne alındığında F grubunda daha az komplikasyon oluştuğu görülmüştür.
Konsantre fibrinojen ile dokuların biyolojik yapışmalarını kolaylaştırma fikri yıllar önce ortaya atılmıştır. Fibrinolizis inhibitörleri ve yeterli derecede konsantre edilmiş fibrinojen elde edilmesindeki güçlük nedeniyle başlangıçta gerçekleştirilememiştir. Biyoteknolojik gelişmeler sonucu faktör XIII (fibrin stabilizing faktör) den zengin kriyopresipitat'ın elde edilmesiyle fibrin yapıştırıcının özellikleri daha iyi anlaşılmış ve uygulama alanları genişlemiştir. Konsantre fibrinojen solüsyonu; faktör XIII, trombin solüsyonu ve kalsiyumdan oluşmuş fibrin yapıştırıcı şeklinde elde edilmektedir 2, 3, 28. Yapılan çalışmada, kombi set I (fibrinojen, koagülasyon faktörü XIII, aprotinin) ve kombi set II (trombin, kalsiyum klorür dihidrat) olarak üretici firma tarafından hazırlanmış fibrin doku yapıştırıcı (Beriplast P Combi-Set 1mL) seti ile dikiş yönteminin, karaciğerde deneysel olarak oluşturulan hasarın onarılması üzerine etkileri değerlendirilmiştir.
Alabaz ve ark. 31 deneysel olarak oluşturdukları aynı derecedeki karaciğer yaralanmalarında fibrin yapıştırıcı kullandıkları grupta hemostazın sağlanmasında oldukça başarı sağladıklarını ve hiçbir komplikasyonla karşılaşmadıklarını bildirmişlerdir. Dikiş uyguladıkları grupta ise kanama, yabancı cisim reaksiyonu ve fibröz doku oluşması gibi komplikasyonların görüldüğünü tedavi uygulanmayan grupta ise organın korunma şansının azaldığını tespit etmişlerdir.
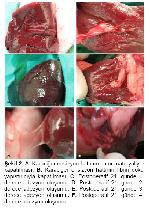
Fibrin yapıştırıcı ve dikiş yönteminin karşılaştırıldığı bu çalışmada, oluşturulan karaciğer ensizyonlarında bölge tamponlanıp ensizyon hattına fibrin yapıştırıcı sürüldükten sonra hemostazın kısa bir sürede (ort. 80 sn) tam olarak sağlandığı ve postoperatif herhangi bir kanamanın meydana gelmediği görüldü. Dikiş uygulanan grupta ise yara dudakları kapatıldıktan sonra da hem ensizyon hattında hem de iğnenin batırıldığı yerlerde kanamanın bir süre daha devam ettiği görüldü (ort. 227 sn).
Bakır ve ark. 20 köpeklerde dalak ve karaciğer travması oluşturarak yapmış oldukları deneysel bir çalışmada postoperatif 10. ve 20. günlerde yapılan relaparatomilerde fibrin grubunda herhangi bir adezyon ve kanamaya rastlamazken, kontrol grubunda tüm olgularda kanama ve iki olguda da adezyon oluşumu, özelliklede ensizyon bölgesine omentumun yapıştığını tespit etmişlerdir. Matris ve ark. 32 da dalak, karaciğer, böbrek ve pankreas gibi parankimal organlarda yapış oldukları cerrahi işlemlerden sonra fibrin yapıştırıcı uyguladıkları hayvanlarda postoperatif önemli bir kanamalara ve ciddi adezyonlara rastlamadıklarını bildirmişlerdir.
Yapılan çalışmada operasyondan sonra 21. günde yapılan relaparatomide F grubu hayvanlarda 3 tavşanda adezyon görülmezken, 3 hayvanda 1. derece, 2 hayvanda 2. derece adezyonla karşılaşıldı. D grubu hayvanlarda ise, 2 tavşanda 2. derece, 3 tavşanda 3. derece, 3 tavşanda da 4. derece adezyon tespit edilmiştir. Dolayısıyla fibrin yapıştırıcının karaciğer yaralanmalarında adezyon komplikasyonlarını azaltacağı kanısına varıldı.
Araştırmacılar 6, 31, 33 karaciğer travmalarında ana ölüm nedeninin kan kaybı olduğunu bu nedenle de karaciğer yaralanmalarında seçilecek tedavi yöntemlerinde iyileşmeyi ve rejenerasyonu arttırıcı etkisinden çok ana amacın kanamayı durdurmak olması gerektiği üzerinde durulmuştur. Yapılan araştırmalarda karaciğer ve dalak kapsulasının yırtılmalarında fibrin yapıştırıcının lokal uygulanması ile hemostazın kısa sürede sağlanmasında başarılar elde edilmiştir. Derin parankimal yaralanmalarda kanamanın etkili bir şekilde kontrolü için fibrin yapıştırıcı yara dudaklarının üzerine veya yara kenarlarının etrafına enjeksiyonu şeklinde uygulanabileceği vurgulanmıştır.
Yapılan çalışmada karaciğer üzerinde 0.5 cm derinliğinde ve 2 cm uzunluğunda oluşturulan ensizyonda kanamanın durdurulması ve yara dudaklarının kapatılması amacıyla fibrin yapıştırıcı üretici firmanın tavsiye ettiği Şekilde ensizyon hattına uygulanmıştır. Yapılan çalışmada fibrin yapıştırıcının karaciğer yaralanmalarında kanamanın durdurulması ve yara dudaklarını kapatılmasında oldukça etkili olduğu tespit edilmiştir.
Karaciğer yaralanmalarında fibrin yapıştırıcı kullanımıyla ilgili yapılan araştırmalarda, fibrin yapıştırıcıların hipotermi ve koagülapatiye rağmen erken hemostazisi sağladığı ve doku iyileşmesini çabuklaştırdığı ileri sürülmektedir 6, 15, 24, 34. Ayrıca araştırmacılar lokal olarak kullanılan fibrinin en iyi fizyolojik yapıştırıcı olduğunu, içeriğindeki trombin ve fibrinojenden dolayı hemostatik bozukluk olsa bile fibrin oluşumunu sağlayabildiğini bildirmişlerdir 15, 27. Yapılan çalışmada ensizyon hattına fibrin yapıştırıcı uygulandıktan sonra bölgeye yaklaşık bir dakika boyunca yeterli basınç uygulanmış ve yara dudaklarının iyi bir şekilde yapıştığı tespit edilmiştir. Bu bulgular araştırıcıların bulgularıyla paralellik göstermektedir.
Araştırmacılar 35-37, karaciğer travmalarına bağlı olarak serum ALT, AST ve ALP düzeyinde artış meydana geldiğini bildirmişlerdir. Bu nedenle karaciğer enzimlerinde meydana gelen bu artışın karaciğer fonksiyon bozukluğunu yansıttığını ve klinik tanı için önemli olduğunu bildirmişlerdir. Yapılan çalışmada da 1, 3, 5 ve 7. günlerde 20 hem D hem de F grubu hayvanlarda ölçülen karaciğer enzim seviyeleri postoperatif olarak artış göstermiştir. Ancak D grubu hayvanlarda meydana gelen artış, fibrin yapıştırıcı uygulanan gruptakilere oranla daha yüksek olarak ölçülmüştür. Yine F grubu hayvanlarda karaciğer enzim seviyeleri D grubuna oranla daha çabuk normal seviyelerine inmiştir (5. gün). Bu sonuçlar göz önüne alındığında fibrin yapıştırıcının karaciğer hasarlarını dikiş uygulamasına oranla daha çabuk onardığı şeklinde değerlendirilmiştir.
Yapılan histopatolojik muayenelerde araştırmacıların 3, 20 bulgularına paralel bulgular tespit edilmiştir. Fibrin yapıştırıcı uygulanan gruptaki hayvanlarda klinik, biyokimyasal ve histopatolojik bulgulara dayanarak karaciğer iyileşmesinin daha önde olduğu belirlenmiştir. Ayrıca D grubu hayvanlara F grubuna oranla daha fazla komplikasyonla karşılaşılmıştır. D grubunda sütur materyallerinin tam olarak rezorbe olmadığı görülmüş ve yabancı cisim dev hücrelerine rastlanmıştır. F grubunda gözlenen yangısal hücrelerden eozinofil lökosit infiltrasyonunun daha şiddetli olduğu, epiteloid hücrelerin mevcut olduğu ancak dev hücrelerin olmadığı dikkati çekmiştir.
Sonuç olarak deneysel olarak yürütülen araştırmada karaciğer ensizyonlarında fibrin yapıştırıcı kullanılan hayvanlarda hemostazın daha etkili bir şekilde sağlandığı, postoperatif komplikasyonların daha az görüldüğü klinik, biyokimyasal ve histopatolojik bulgular göz önüne alındığında D grubuna oranla karaciğer iyileşmesinin kalite ve hızının arttığı tespit edilmiştir. Bu nedenle karaciğer onarımlarında fibrin yapıştırıcının dikiş materyallerine tercih edilmesi gerektiği kanısına varılmıştır.