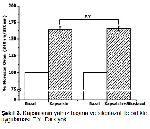
Periferal arter hastalığı (PAH) dünya genelinde en
önemli kardiyovasküler problemlerden biridir
1. Diyabet,
hipertansiyon, hiperlipidemi ve sigara kullanımı PAH
riskini artırmaktadır
2,3. Alt ekstremiteleri tutan orta
dereceli PAH'nın en sık rastlanan semptomu aralıklarla
ortaya çıkan ağrıdır ve genellikle intermitan klodikasyon
şeklinde isimlendilen bir yürüme bozukluğu şikayetidir
4. İntermitan klodikasyon kişide egzersiz ve yüreme
yeteneğini sınırlamakta ve egzersize bağlı iskemi
nedeniyle bacak kaslarında ağrı meydana gelmektedir.
İntermitan klodikasyonun tedavi seçenekleri arasında
yaşam stilinin değişimi, ilaç tedavisi ve egzersiz yer
almaktadır
5.
Silostazol antiplatelet, antitrombotik ve vazodilatatör
etkilere sahip selektif fosfodiesteraz-3 inhibitörüdür ve
İntermitan klodikasyonun periferal vasküler hastalık
tedavisinde kullanılmaktadır6,7.
Ağrı iletimi periferal reseptörlerin (nosiseptör)
uyarılmasını takiben, dorsal kök gangliyonları (DKG)
nöronları, spinal kord ve beyin sapını da içeren ağrı
yolakları vasıtasıyla, merkezi sinir sisteminin daha üst
seviyelerine bu nosiseptörler ile iletilir8. Yapılan
çalışmalar doku hasarını takiben DKG nöronlarındaki
voltaj ve ligand kapılı iyon kanallarının fonksiyonunda ve
ekspresyonunda değişim meydana getirdiğini
göstermiştir9,10. Bununla birlikte, bu iyon kanallarının
farmakolojik, fizyolojik ve moleküler yapısı tam anlamıyla
aydınlatılamamıştır11.
DKG nöronları çaplarına göre küçük, orta ve büyük
olmak üzere üç alt sınıfa ayılmaktadır.12 Küçük çapa
sahip olan DKG nöronları (<30 μm) potansiyel
nosiseptörler olarak değerlendirilirken, daha büyük çapa
sahip nöronlar ise genelde non-nosiseptif nöron oldukları
kabul edilir12.
Kalsiyum iyonu, aralarında nörotransmitter salınımı,
gen ekspresyonu, mRNA stabilitesi ve nöronal
uyarılabilirlik gibi birçok fizyolojik olayın
düzenlenmesinde rol oynayan bir “ikincil haberci”dir.
Ayrıca hücre içine yüksek miktarda Ca+2 akışı ve hücre
içi kalsiyum konsantrasyonunun ([Ca2+i) aşırı artışı
nöronal hasara yol açarak pek çok nörodejeneratif
hastalığın patogenezinde rol oynamaktadır. Bu sebeple
[Ca+2i sıkı bir kontrol altındadır13.
Bu çalışmanın amacı intermitan klodikasyonun
tedavisinde kullanılan silostazolun küçük çapa sahip
DKG nöronlarında [Ca2+i
düzeyi üzerine olan etkisini
kalsiyum görüntüleme yöntemi kullanarak incelemekti.