Tanısal amaçlı görüntülemenin medikal gelişimin ön sıralarında yer aldığı kuşkusuzdur
23. Modern görüntüleme yöntemlerinin doğrudan faydaları arasında daha efektif cerrahi tedaviye zemin hazırlaması
24, hastanede kalış süresini kısaltması
25, bazı vakalarda gereksiz eksplorasyonun önlenmesi
26, kanser evrelemesinin daha doğru yapılması ile tedaviye cevabının daha doğru bir şekilde değerlendirilmesi sayılabilir
27. Ancak medikal görüntülemeden kaynaklanan iyonize radyasyonun hasta üzerinde meydana getirebileceği olası potansiyel etkiler son yıllarda dikkat çeken bir konu haline gelmiştir
28.
Günümüzde, örneğin Amerika Birleşik Devletlerinde medikal amaçlarla oluşan radyasyon maruziyeti insan yapımı tüm radyasyon maruziyetlerinin %95‘inden fazlasını meydana getirmekte, tüm radyasyon maruziyetlerinin ise yarısını oluşturmaktadır28. ABD'de medikal görüntüleme sebebiyle hastaların maruz kaldığı total radyasyon dozu son 15 yılda 6 kat artmıştır29,30. Tüm dünya çapında tahminen yıllık 3.1 milyar radyografik proses ve 37 milyon diagnostik nükleer tıp uygulaması gerçekleştirilmektedir28.
Epidemiyolojik çalışmalar 5 ile 125 mSv aralığında meydana gelen radyasyon maruziyeti ile kanser riskinde, düşük, fakat istatistiksel olarak anlamlı bir artışın meydana geldiğini göstermektedir31. Son 15 yılda, medikal görüntülemede BT, PET/BT ve myokard perfüzyon sintigrafisi gibi daha yüksek doz radyasyon maruziyetine sebep olan yöntemler yaygın olarak kullanılmaya başlanmıştır28. Bunlardan PET/BT kullanımı son 5 yılda kayda değer bir şekilde artarak ABD'de yıllık yaklaşık 1.5 milyon düzeyine ulaşmıştır32. Bu görüntüleme yönteminde radyasyon maruziyeti BT ve pozitron yayan radyofarmasötiklerin birlikte kullanımı sebebiyle oluşmakta ve özellikle mesane duvarı gibi bazı pelvik yerleşimli organlar daha fazla etkilenmektedir33.
BT, PET/BT görüntülemenin komponentlerinden biridir. Çeşitli nedenlerle hastalara pelvik ve abdominal BT uygulaması yapılmakta ve uterus ile fetüsün direkt radyasyon maruziyeti meydana gelmektedir34. Bu durumlar genelde hasta gebe olduğunun farkında değilse oluşmaktadır. Buna ek olarak pulmoner emboliden şüphelenilen hastalarda torakal BT yapılabilmektedir. Bu yolla uterus ve konseptus radyasyona maruz kalabilmektedir35,36. Uterusun torakal BT sonucu aldığı radyasyon dozu 66.5±3.1 µGy olarak verilmiştir37. Konvansiyonel torakal BT ile verilen radyasyon dozu akciğer grafisinden yaklaşık 100 kat ve mamografiden yaklaşık 10 kat fazladır. Bununla birlikte torakal BT'nin pelviste mevcut organlar için güvenli olduğu düşünülmektedir38. BT görüntülemede uterusun aldığı dozlar literatürde terapötik değerin altında ortaya konmaktadır. Bu değerler torakal BT için 66.5±3.1 µGy olarak verilirken abdominal BT için 0.335 ile 0.785 mGy aralığında verilmektedir38,39. PET/BT prosedürü esnasında hem torakal, hem abdominal, hem de pelvik BT çekimi yapılmakta, bunlara ek olarak 511 kev'lik pozitron ışıması yapması nedeniyle FDG uygulaması da uterusu radyasyona maruz bırakmaktadır.
VEGF üretimi ultraviole-B radyasyon tarafından güçlü bir şekilde uyarılır ve yara yeri iyileşmesi ile anjiogenezin bir parçası olarak fonksiyon görür40. Ayrıca iskemik ve hipoksik süreçler de normal veya tümöral dokunun radyoterapötik cevabını arttıran faktörler olarak karşılaşılır41. Radyoterapi ile uygulanan radyasyon VEGF seviyesini arttırmaktadır ve VEGF endotelyal hücrelerin radyasyona karşı direncinden sorumlu tutulmaktadır42. Rabbani ve ark.43'nın yapmış olduğu bir çalışmada radyasyon uygulaması sonucu, normal dokuda, HIF-1 artışı ile birlikte anjiogenezisi pozitif yönde etkileyen VEGF seviyelerinde de yükselmenin meydana geldiği ortaya konmuştur.
Bu çalışmada ise radyasyon uygulanan grupların hiçbirinde VEGF düzeyi artmamıştır. Aktaş ve ark.44 yaptıkları bir çalışmada, vasküler endotelyal hücrelerde radyasyon maruziyeti sonrası 24. saatte VEGF seviyelerinde ılımlı bir artışın meydana geldiğini, 48. saatte ise VEGF'deki artışın yüksek seviyelerde olduğunu belirlemişlerdir. Bu çalışmada VEGF seviyelerinin artmaması, dokulardaki VEGF düzeyine, radyasyon maruziyetinden 24 saat sonra bakılması nedeniyle olmuş olabilir. Rabbani ve ark.43 kırk sekizinci saatteki bu yükselmenin HIF-1α artışı ile ilişkili olduğunu iddia etmişlerdir. Ayrıca yine Aktaş ve ark.44 aynı çalışmalarında normal dokuya tek doz 10 Gy iyonize radyasyon uygulamışlar ve HIF-1α ile VEGF seviyelerinin 7. Günde normale döndüğünü ortaya koymuşlardır. Imaizumi ve ark.45 2010 yılında, sağlıklı farelerin normal dokuları üzerinde 8 Gy, 15 Gy ile 20 Gy tek doz radyasyon uygulayarak gerçekleştirdikleri bir çalışmada da 5. günde endotel hücrelerindeki VEGF düzeylerinin normal olduğu sonucuna varmaları literatür ile uyumludur.
Radyasyon toksisitesi, radyasyon maruziyetinden sonra reaktif oksijen radikallerinin geniş çaplı oksidatif hasara yol açması ile ilişkilidir16,17. Reaktif oksijen radikalleri terimi hidrojen peroksid (H2O2), singlet oksijen, süperoksid anyonu, hidroksil radikali gibi ürünleri kapsamaktadır. Bu ürünler potansiyel karsinojenlerdir ve DNA, hücre membranı, enzimler gibi hücre için önemli bileşikler üzerine etki ederek hücre ölümüne sebep olabilirler46.
Lipid peroksidasyonu lipidlerin karbon-karbon çift bağlarının oksidatif olarak yıkılması ve çok sayıda toksik son ürünün meydana gelmesi olarak tanımlanabilir47. Hücre membran lipidleri serbest oksijen radikallerinin meydana getirdiği hasara karşı çok duyarlıdır48. Lipid peroksidasyonu sırasında çok sayıda farklı aldehitler meydana gelir, MDA bunlardan biridir49 ve en mutajenik lipid peroksidasyon ürünü olarak görülmektedir50.
Ratlarda elektromanyetik radyasyon maruziyeti ile endometriumda nitrik oksid gibi oksidan ürünlerin ve malondialdehit gibi lipid peroksidasyon ürünlerinin seviyelerinin arttığı ve bu artışın kombine vitamin E ve C alımı ile anlamlı derecede azaltıldığını ortaya koyan çalışmalar bulunmaktadır51.
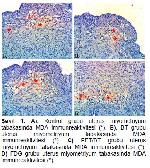
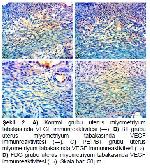
Bu çalışmada BT, PET ve PET/BT çekimlerinde kontrol grubuna göre MDA düzeylerinde anlamlı bir farklılık saptanmamıştır. Deneyde gerçekleştirilen görüntülemelerin uterusta, MDA düzeylerinde belirgin bir değişiklik yapmaması bu çekimlerin uterusta belirgin oksidatif stres oluşturmadığı şeklinde yorumlanabilir. Bu çalışmanın sonuçlarının ortaya koyduğu VEGF düzeyleri ile de uyumludur. Ancak ratların uterus örneklerinin 24. saatte alındığı göz önünde bulundurulursa bu örneklerin daha geç alınması durumunda MDA ve VEGF düzeylerinin değişebilmesi söz konusu olabilir. Bir başka nokta ise ratlara sadece bir kez çekim yapıldığıdır. Tekrarlayan çekimlerin uterus dokusundaki MDA düzeylerini arttırabileceği göz önünde bulundurulmalıdır.
Sonuç olarak, bu çalışmada kontrol grubu ile karşılaştırıldığında; BT, PET ve PET/BT'nin uterus dokusunda MDA ve VEGF immünreaktivitesini değiştirmediği ancak gelecekte farklı doz ve süreler ile yapılacak çalışmalara ihtiyaç olduğu kanaatine varılmıştır.