Organizmaların hayatta kalabilmesi için hücrelerin
çoğalması gerekmektedir. Normal koşullarda
organizmada hücre yenilenmesinin denge halinde
devam etmesi önem arz etmektedir. Bu denge çeşitli
genler tarafından kontrol altında tutulmaktadır. Bu
genlerin bazıları hücre çoğalmasını sağlarken, bazı
genler ise aşrı hücre çoğalmasını engelleyici etki
göstermektedir. Bazen çevresel faktörlere bağlı olarak
bu genlerde görülen çeşitli değişiklikler, hücre
yenilenmesi döngüsünün kontrolsüz hücre
çoğalmasına dönüşmesine neden olmaktadır.
Hücrelerin kontrolsüz büyüme ve yayılma özelliğine
sahip olması ile gelişen hastalığa kanser adı verilir
24.
Kanser, dünya genelinde giderek artan bir sağlık
problemidir ve toplumlarda önemli bir sosyo-ekonomik
yüke, bireylerde de maddi ve manevi kayıp ve
zorluklara yol açmaktadır. Yeni yayımlanan dünya
kanser istatistiklerine göre; ölüm nedenleri arasında
kanser ilk sırada yer almaktadır 25. Dünyada 2012
yılında 14 milyon yeni kanser vakası, 8,2 milyon
kanserden ölüm bildirilmiştir. Gelecek 20 yılda yeni
vaka beklentilerinin %70 civarında artacağı
düşünülmektedir 26. Türkiyede, prostat kanseri
erkeklerde en çok görülen kanser türleri arasında 2.
Sıradadır (%11.8). Over kanseri ise kadınlarda en çok
görülen kanser türleri arasında 7. Sıradadır (%3.9) 3.
Günümüzde kanser tedavisinde kullanılan
ilaçların birçoğu sitotoksiktir. Sitotoksik ilaçların sadece
kanser hücrelerini değil, aynı zamanda normal vücut
hücrelerini de etkiledikleri bilinmektedir. Bundan dolayı
kanser tedavisinde umut veren bazı ilaçların vücuda
zararlı etkileri de olmaktadır. Bu sebeble kanser
hücrelerine yönelik daha spesifik yeni ajanların
tasarlanmasına ihtiyaç duyulmaktadır 27.
ACA ilk olarak lökotrien C4 ve D4 antagonisti
olarak bronkokonstriksiyon etkisiyle tanınmıştır 28.
PLA2 inhibisyonu gerçekleştirdiği ortaya konan ACA
nın; PLA2 inhibitör aktivitesi yanında daha sonra
pankreas adacıklarında glikoz ile gerçekleşen insülin
salgısını inhibe ettiği gösterilmiştir 29. Daha sonraki
yıllarda yapılan çalışmalarda ACAnın TRPM2
kanallarını bloke ettiği gösterilmiştir. ACAnın etkisi
daha zayıf olsa da aynı zamanda TRPC6 ve TRPM2
kanalıyla yakın ilişkili olan TRPM8 kanalını inhibe ettiği
gösterilmiştir 5.
TRPM2 kanalları kalsiyum geçirgen non-selektif katyon kanalıdır. TRPM2 kanalı, kanala bağlı olarak hücre içinde enzim bulundurması ve oksidatif stresle aktive olması nedeniyle spesifik bir iyon kanalıdır. TRPM kanalları hayatta kalım ve proliferasyon gibi çeşitli hücresel fonksiyonları olan TRP kanal ailesinin üyesidir 30. TRPM kanallarından biri olan TRPM2 vücutta birçok hücrede ekprese edilmiştir 31. TRPM kanallarının kanser hücrelerinde de ekspresyonu görülmüş olup ekspresyon seviyesinin tümör büyümesi ile ilişkili olduğu gösterilmiştir 32. Prostat kanseri hücrelerinde TRPM2 ekpresyonunun sağlıklı hücrelere göre arttığı gösterilmiştir. TRPM2 kanallarının inhibisyonunun ise bening prostat hücrelerinde proliferasyonu etkilemezken, PC-3 hücrelerinin proliferasyonu azalttığı gösterilmiştir 33. Bao ve ark. 34 yaptığı çalışmada TRPM2 kanallarının azalmasının tümör büyümesini inhibe edip doxorubicinin etkisini artırdığı gösterilmiştir.
PLA2nin hücre büyümesi, hücre ölümü ve inflamasyonun düzenlenmesi gibi çeşitli fonksiyonları vardır. PLA2 izoformlarının aktivitesi ve ekspresyonunun çeşitli insan kanser türlerinde arttığı gösterilmiştir. PLA2 inhibitörlerinin çeşitli kanser türlerinde tümör büyümesini azalttığı ortaya konmuştur 12. Song ve ark. 35, Schulte ve ark. 36 yaptığı çalışmalarda PLA2 inhibisyonunun over kanser hücrelerinde proliferasyonu baskıladığı rapor edilmiştir 36. Sved ve ark. 37 yaptığı çalışmada PLA2 inhibisyonunun prostat kanser hücrelerinde proliferasyonu azalttığı gösterilmiştir.
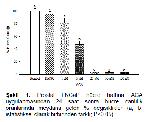
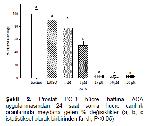
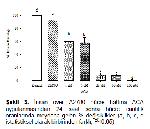
TRPM2 ve PLA2 inhibisyonunun anti-kanser özelliği göstermesi, hem TRPM2 hem de PLA2 inhibitörü ACAya kanser hücrelerinin proliferasyonunu önlemede avantaj sağlamaktadır. Nitekim çalışmada PC-3, LNCaP ve A2780 hücrelerinde ACA uygulaması hücre canlılığını azaltmıştır. A2780 hücre hattında tüm konsantrasyonlarda istatistiksel olarak hücre canlılığını azaltmıştır. PC-3 (androjen reseptör bağımsız insan prostat kanser hücre hattı) ve LNCap (Androjen reseptör bağımlı insan prostat kanseri hücre hattı) kültür ortamına eklenen ACAnın 1 μM dışındaki tüm konsantrasyonlarının istatistiksel olarak anti-kanser aktiviteye sahip olduğu görüldü. ACAnın Hem PC-3 hem de LNCaP hücrelerinde aynı konsantrasyonlarda benzer etkiler göstermesi; bu etkinin androjen reseptöründen bağımsız olduğunu göstermektedir. Tahmini olarak hesaplanan ACAnın LogIC50 ve IC50 konsantrasyonlarından yola çıkarak ACAnın düşük konsantrasyonda en yüksek sitotoksik etkiyi sırasıyla LNCaP, PC-3 ve A2780 hücrelerinde gösterdiğini söylemek mümkündür.
Bu çalışmada, TRPM2 ve PLA2 inhibitörü olan ACAnın A2780, LNCaP ve PC-3 hücreleri üzerinde güçlü sitotoksik aktiviteye sahip olduğu görülmektedir. Bu sonuçlar insan over ve prostat kanseri tedavisinde ACAnın önemli etkilere sahip olabileceğini işaret etmektedir.