Karaciğer ilaç toksisitesine karşı oldukça duyarlı bir organ olup, DOX kaynaklı hepatotoksisite hakkında literatürde çok sayıda rapor mevcuttur
7,18. Hepatositlerin hücre zarları, DOX kaynaklı serbest radikal hasarına karşı savunmasızdır. DOX kaynaklı oksidatif stres DNA, RNA ve protein sentezini bozar. Bu durum, hepatik enzim düzeylerini etkiler ve hepatositlerin nekrozuna veya apoptozuna yol açar
19.
Ayrıca DOX aracılı artan ROT seviyeleri, mitokondriyal disfonksiyona neden olur. Son yıllarda, DOX kaynaklı hepatotoksisitede önemli rol oynayabilecek alternatif mekanizmaları tespit etmek için yapılan araştırmalar daha çok mitokondriyal füzyon ve fisyon proteinlerine odaklanmıştır. Bunun yanı sıra antioksidan takviyelerinin, klinik çalışmalarda, DOX kaynaklı toksisiteye karşı koruma gösterdiği bildirilmiştir 20.
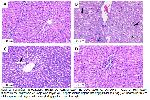
Antrasiklinlerin, hücre hasarına yol açacak şekilde hücrelerin makromolekülleri ile etkileşime giren reaktif oksijen türleri oluşturmak için moleküler oksijen ile reaksiyona giren semikinon radikal ara ürünü oluşturduğu bilinmektedir 21. DOX uygulanan sıçanların karaciğerinde meydana gelen histopatolojik değişiklikler; doksorubisinden oluşan reaktif ara ürünün (doksorubisin semikinon) neden olduğu artan oksidatif strese bağlı olabilir. DOX ile birlikte HST uygulanmasının bu histopatolojik değişiklikleri azaltmasınının ve karaciğerdeki hasarı büyük oranda iyileştirmesinin, HSTnin antioksidan özelliğinden kaynaklandığını düşünmekteyiz.
Çalışmada DOX tedavisinin serum TAS düzeylerinde belirgin bir azalmaya, TOS düzeylerinde ise artışa neden olduğu belirlendi. DOX ile birlikte HST uygulanmış sıçanlar ise TAS düzeylerinde artış, TOS düzeylerinde ise azalma gösterdi. Bu durum DOX ile karaciğer dokusunda oksidatif hasarın oluştuğunu göstermekte ve karaciğerde meydana gelen histopatolojik değişiklikleri de desteklemektedir.
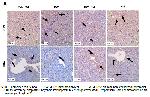
Mitokondrinin işlev bozukluğunun ATP üretiminde azalmaya, hücresel işlevlerde ve yapıda değişikliklere yol açtığı gösterilmiştir 22. DOX'un genel toksisitesi, ROT'un aşırı üretimi ve oksidatif stresle sıkı bir şekilde ilişkili olan mitokondrinin işlevselliğindeki bozukluklarla 23 ilişkili görünmektedir 24. Bu nedenle, mitokondriyal disfonksiyonun ortadan kaldırılması, DOX uygulanan sıçan modellerinde karaciğer hasarını iyileştirme potansiyeline sahiptir. Bhargava ve ark. 22 DRP1 inhibisyonunun mitokondriyal fisyonu bloke ederek iskemik böbrek hasarını iyileştirebileceğini belirtmişlerdir. Başka bir çalışmada DRP1 aracılı mitokondriyal fisyonun, DOX kardiyotoksisitesinin başlatılmasında rol oynadığı gösterilmiştir 25. Ayrıca Dai ve ark. 26, DRP1 aşırı ekspresyonunun ROT oluşumunu arttırdığını bildirmişlerdir. Çalışmada da yukarıdaki verilerle uyumlu şekilde DOX uygulamasıyla aşırı artan, HST tedavisi ile normal seviyelere düşen DRP1'in DOX'un neden olduğu karaciğer hasarında rol oynadığı düşünülebilir. Buna karşın MFN2, mitokondri füzyonunda önemli bir rol oynar ve mitokondriyal fonksiyon için kritiktir. Artan kanıtlar, MFN2 ekspresyonundaki artışa bağlı mitokondriyal füzyonun mitokondriyal işlevi optimize etmeye hizmet ettiğini göstermektedir. Örneğin, MFN2 baskılanması mitokondrinin parçalanmasına yol açarken, MFN2'nin indüksiyonu ROT seviyelerini düşürür ve ATP seviyelerini düzenler 27. DOX kaynaklı hepatoksisitede artan DRP1 ve azalan MFN2 düzeyleri bu hasarın mekanizmasında mitokondriyal fisyon-füzyon dengesinin bozulmasının gerçekleştiğini kanıtlar niteliktedir.
Literatürde DOX ile indüklenmiş karaciğer hasarına karşı güçlü bir antioksidan olan HSTnin etkilerinin ve bu etkide mitokondriyal füzyon-fisyon dengesinin düzenlenmesinde oldukça önemli olan DRP1 ve MFN2nin rolünün araştırıldığı çalışmaya rastlanılmamıştır. Bu çalışmanın ana sonucu, HST'nin DOX kaynaklı oksidatif stresi inhibe edebildiğidir. Ayrıca HST, karaciğerde DOX ile indüklenen histopatolojik değişiklikleri iyileştirir. Öte yandan, DRP1 ve MFN2nin bu etkilere aracılık ettiği düşünülebilir.