CYP, lösemi ve lenfoma ve meme, akciğer, prostat ve yumurtalık kanserleri gibi geniş bir malignite spektrumuna karşı etkilidir
11. Ancak kullanıldığı dozlarda birçok organ ve sistem üzerinde yan etkiler oluşturmaktadır. Normal veya hastalıklı dokuda ortaya çıkan bu çok sayıda yan etki CYP kullanımının en büyük sınırlayıcısıdır. CYP tedavisi hayati organlarda peroksidatif hasara neden olan ROS üretimiyle sonuçlanır
12. İlaca veya toksine bağlı karaciğer hasarının patogenezi genellikle bir bağışıklık tepkisi ortaya çıkaran veya hücrenin biyokimyasını doğrudan etkileyen toksik metabolitlerin katılımını içerir. CYPnin, antioksidan alımının kemoterapi reaksiyonlarını kontrol etmeye yardımcı olduğu ve antineoplastik ilaçların olumsuz yan etkilerini en aza indirdiğini bildirmiştir
13. İlaç metabolitleri, kovalent bağlanma, azaltılmış glutatyonun tükenmesi veya oksidatif stres dahil olmak üzere proteinler, lipitler ve DNA üzerinde etkileri olan çeşitli kimyasal reaksiyonlara maruz kalabilmekte veya bunları teşvik edebilmektedir
14.
RSV, etanol ve karbontetraklorür (CCI4) gibi iyi bilinen hepatotoksinler için karaciğer hasarına karşı koruma sağlar 15,16. RSV ün karaciğeri koruyucu olası mekanizmaları arasında; pro-enflamatuar mediatörlerin salınımı ve sentezinin inhibibisyonuyla enflamatuvar yanıtı baskılaması, eikosanoid sentezinin modifikasyonu, kupffer hücreleri ve adezyon moleküllerinin inhibisyonu, aktive olmuş immün hücrelerin baskılanması veya indüklenebilir nitröz oksit sentaz (iNOS) ve siklooksijenaz 2 (COX-2)nin inhibisyonu sayılabilir 17. RSVün birçok kanser vakasında anti-kanserojen olarak kullanıldığı da bildirilmektedir 18. Toksik maddelere maruziyet ve ilaç kullanımının yan etkilerine bağlı olarak oluşan karaciğer hasarı oldukça önemlidir. Oksidan ve antioksidan sistemler arasındaki dengenin serbest radikaller lehine bozulması olarak tanımlanan oksidatif stres, birçok patolojik durumda ortaya çıkmaktadır 19. Bu süreçte özellikle serbest oksijen radikalleri ve artmış hidrojen peroksit gibi prooksidan yapılar hasarı artırmaktadır.
Çalışmanın biyokimyasal sonuçlarına göre; sıçanlara CYP verilmesinin ardından kontrol grubuna kıyasla MDA seviyesinin arttığı, RSV verilen grupta ise MDA seviyesinin istatiksel olarak anlamlı düzeyde azaldığı belirlenmiştir. CYP verilen grupta, kontrol grubuna kıyasla karaciğer katalaz aktivitesinin azaldığı, sadece RSV ve CYP+RSV grupların da ise katalaz aktivitesinin arttığı gözlemlendi. Bu bulgular CYP verilmesi sonucu oluşan lipit peroksidasyonunun ve hidrojen peroksit artışının, hücresel hasara neden olduğunu ve oluşan serbest radikallerin hücresel savunmayı azalttığını göstermektedir. CYP uygulamasıyla oluşan hücresel hasarın, RSV verilen gruplarda MDA seviyesinde azalma, CAT aktivitesinde ise artma sağlaması RSVün iyileştirici etkisinin bir göstergesidir. Bu sonuçlar, karaciğer hasarını önleme ve düzeltme açısından güçlü antioksidan özelliklere sahip RSV ün kullanılmasını destekler niteliktedir.
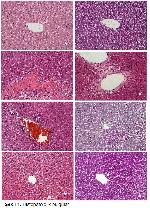
Çalışmanın histopatolojik bulguları RSVün; CYP ile indüklenen oksidatif ve enflamatuvar olaylara karşı koruyucu potansiyel sergilediğini gösterir niteliktedir. Histopatolojik çalışmalarda CYP verilen grupta karaciğer dokularındaki sinüzoidal boşlukların şiştiği ve sayıca azaldığı gözlendi. Bunun nedeni, CYP metabolitlerinin hücre zarını tahrip etmesidir 2. Bu nedenle, toksisiteyi azaltabilen ve CYPin etkili bir şekilde kullanılmasını sağlayan güçlü kemoprotektif ajanlara ihtiyaç vardır, böylece CYP tedavisi gören hastaların yaşam kalitesinde de iyileşme olacaktır.
Bu çalışmanın sonuçları; CYP uygulamasının karaciğerde oksidatif stres artışına ve doku hasarına neden olduğunu göstermektedir. CYP ile birlikte, bu dozda ve sürede RSV uygulanmasının ise karaciğer dokusunda antioksidan enzim aktivitesini artırdığı, doku hasarını azalttığı tespit edildi. Bu nedenle de RSVün kemoterapi ilaçlarının yan etkilerinin azaltılmasında etkili bir aday olabileceği söylenebilir. Bu iki ajanın birlikte kullanımı ile ilgili daha ileri çalışmalar yapılmasına ihtiyaç vardır.