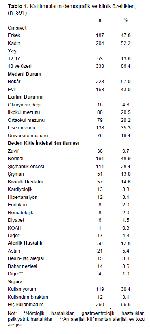
Bu çalışma, Fırat Üniversitesi Tıp Fakültesi Hastanesi COVID-19 Aşı Polikliniğine başvuran kişiler arasında BNT162b2 COVID-19 aşısının güvenlik ve yan etki profilini analiz etmeyi amaçlamıştır. Çalışma sonuçlarına göre, enjeksiyon bölgesinde lokalize ağrı ile yorgunluk, kas, eklem ve baş ağrısı gibi sistemik reaksiyonlar en sık bildirilen yan etkilerdir. Reaksiyonlar genellikle kendi kendini sınırlayıcı nitelikte olup, anafilaksi rapor edilmemiştir. Cinsiyet ve COVID-19 aşısından önce COVID-19 geçirme durumu ile yan etki görülmesi arasında anlamlı ilişki saptanmıştır.
Çalışmamızda katılımcıların %29.7si birinci doz aşı uygulamasından sonra, %30.4ü ikinci doz aşı uygulamasından sonra yan etkileri azaltmak için ağrı kesici kullanma ihtiyacı duymuştur. Alamer ve ark.larının yaptığı 12-18 yaş 571 çocuğun olduğu çalışmada katılımcıların %65.0ı yan etkileri azaltmak için ilaç almıştır 19. Çalışmamızda ayrıca yalnızca iki kişi birinci doz aşı sonrası, dört kişi ikinci doz aşı sonrası görülen yan etkiler için hastaneye ayaktan acil poliklinik servisine başvurmuştur (Tablo 2). Alamer ve ark.larının çalışmasında ise katılımcıların %14.0ü yan etkiler nedeniyle doktora gitmiş, %8.0ı da yan etkiler nedeniyle hastaneye yatmıştır 19. Sadece 12-18 yaş arası çocukların incelendiği Alamer ve arkadaşlarının çalışmasında yan etki nedeniyle ilaç kullanma ve hastaneye başvurma sıklıklarının 12 yaş ve üzeri kişilerin incelendiği mevcut çalışmaya göre daha fazla olması çocuk yaş grubunda endişeli ebeveynlerin yönlendirmesi nedeniyle olabilir 19.
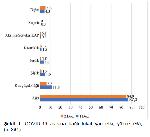
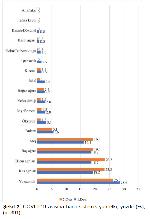
Mevcut çalışmada COVID-19 aşısına bağlı bildirilen en sık yan etkinin enjeksiyon bölgesinde ağrı olduğu bulunmuştur (Şekil 1, birinci doz için %87, ikinci doz için %84.9). Bu bulgu ile benzer şekilde 12 çalışmayı dâhil eden sistematik bir derlemenin sonuçlarına göre %84.1 ile enjeksiyon bölgesinde ağrının COVID-19 aşısına bağlı en sık yan etki olduğu bildirilmiştir 20. Bu çalışmada enjeksiyon bölgesinde ağrıdan sonra en sık görülen yan etkinin yorgunluk olduğu saptanmıştır (Şekil 2). Benzer çalışmalarda 20-22 da en sık ikinci yan etkinin halsizlik olduğu belirtilmiştir.
Aşılara karşı immün yanıttaki varyasyonun, cinsiyet farklılıkları ile ilgili olduğuna inanılmaktadır 23. Bu çalışmada kadın katılımcılarda yan etki görülme sıklığı erkek katılımcılara göre istatistiksel anlamlı olarak daha fazladır (Tablo 3). Kadınlarda ve erkeklerde yan etki görülme sıklığı sırasıyla birinci doz için %94.6 ve %85.6; ikinci doz için %93.1 ve %80.7; total doz için ise %98.0 ve %90.4 olarak bulunmuştur. Çalışmada elde edilen bulgular, kadın katılımcıların erkek katılımcılardan daha fazla yan etki bildirdiğini gösteren benzer çalışmalarla uyumludur 24,25.
Mevcut çalışmamızda COVID-19 enfeksiyon öyküsü olmayanlara kıyasla aşılamadan önce COVID-19 geçirme öyküsü olanlarda daha fazla yan etki görülmüştür (Tablo 3). Bu bulgu literatürle uyumludur 26,27. Bu gözlem, bağışıklık sisteminin tepkisi şeklinde yorumlanabilir. Literatürde, daha önceden COVID-19 enfeksiyonu geçiren bireylerde tek bir aşı dozuna verilen antikor tepkilerinin, daha önce COVID-19 geçirmemiş bireylerde bulunan antikor titrelerine eşit veya daha yüksek olduğu bildirilmektedir 28. Bu tür gelişmiş bağışıklık, daha önce COVID-19 ile enfekte olmuş kişilerde birinci veya ikinci dozları takiben sistemik yan etkilere aracılık ederek; kaslar, kan damarları ve diğer dokular üzerinde inflamatuar bir etkiye sahip olabilecek sitokinlerin üretimini indükleyebilir 29.
Bu çalışma bazı kısıtlılıklar taşımaktadır. Çalışma, katılımcıların anket formlarında bilgi yanlılığına neden olabilecek, yani bazı katılımcıların diğerlerine göre olumsuz etkileri bildirme olasılığı daha yüksek olabilen verileri kullanmış olabilir. Mevcut çalışmanın bir diğer sınırlaması, aşının kısa vadeli yan etkilerinin (enjeksiyondan bir hafta sonra) izlenmesidir. Aşının orta ve uzun vadeli yan etkileri hala bilinmemektedir. Tromboembolik profiller ve miyokardit gibi COVID-19 aşısını takiben diğer nadir olayları değerlendirmek gelecekteki çalışmalar için önemli olacaktır 30.
Sonuç olarak katılımcıların çok büyük çoğunluğunun mRNA aşısına bağlı yan etki yaşadığı saptanmıştır. En sık görülen lokal yan etki ağrı, sistemik yan etki ise yorgunluktur. Kadınlarda ve aşıdan önce COVID-19 geçirenlerde COVID-19a bağlı yan etki daha sık görülmektedir. Aşıya bağlı uzun vadeli yan etkilerin incelenmesi için kohort çalışmalarına ihtiyaç vardır. Elde edilen sonuçlar, kullanıma girmiş olan BNT162b2 aşısının yol açabileceği yan etkiler konusunda yol gösterici olabilecektir.