Örneklerin Toplanması
Bu çalışma 1 Haziran 2006-31 Ocak 2007 tarihleri arasında Kahramanmaraş Devlet Hastanesi dermatoloji kliniğine başvuran mantar infeksiyonu tanısı konulan hastalardan 338 olgudan deri ve tırnak kazıntı örnekleri incelendi. Lezyon deride ise steril bistüri ile lezyonun kenarlarından steril petri kaplarına kazıntı örnekleri alındı. Tırnak lezyonlarında sağlam dokulara ulaşılıncaya kadar kazıntı örnekleri ve tırnak parçaları alındı. Alınan örnekler direkt mikroskobi ile incelendikten sonra SDA besiyerlerinde kültürleri yapıldı.
Örneklerin Direk Mikroskobik Olarak İncelenmesi
Laboratuara getirilen saç ve deri kazıntı örnekleri, % 15 lik KOH çözeltisinden bir iki damla temiz bir lam üzerine damlatıldı ve alınan örnekten öze ile lam üzerine konularak lamel kapatıldı. Oda ısısında 20-25 dakika bekletildi, daha sonra mikroskopda önce 10'luk sonra 40'lık büyütmede artrosporlar, tomurcuklanmış blastosporlar araştırıldı. Mantar elemanları gözlenen örnekler pozitif, görülmeyenler negatif olarak değerlendirildi12.
Örneklerin Ekilmesi ve Kültürü
SDA besiyerlerine delme yöntemi ile üçlü ekim yapıldı. Kültürler inkübasyon sırasında haftada 2-3 kez kontrol edildi. Ekim yapılan kültürlerden ikisi oda sıcaklığında, biri 37 ºC de en az 4 hafta bekledikten sonra değerlendirmeye alındı.Üreme tespit edilmeyen kültürler negatif olarak değerlendirildi13.
Kültürde Üreyen Mantar Kolonisinin İdentifikasyonu
Kolonilerin yapısı makroskobik ve mikroskobik olarak incelendi.
Koloninin Makroskobik İncelenmesi: Ekimi yapılmış kültürler inkübasyon süresi sonunda, yüzey(havasal miçel) ve taban rengi, yüzey örgüsü(çıplak, mumsu, pudramsı, granüler, süet benzeri, kadifemsi, tüylü, kabarık), topografisi(düz, kabarık, dağınık), koloninin büklüm şekli(ışınsal, beyin krater gibi) ve üreme hızına göre incelendi.
Koloninin Mikroskobik İncelenmesi: Bu inceleme makrokonidiyum ve mikrokonidiyumların varlığınının belirlenmesi, hiflerin yapısının incelenmesi amacı ile yapıldı14.
Enzimatik Aktivitelerin Belirlenmesi
Kazeinolitik Özelliklerin Belirlenmesi: Trichophyton rubrum ve Trichophyton mentagrophytes'in proteaz aktivitelerinin olup olmadığının belirlenebilmesi için özgün bir besiyeri kullanıldı. Bunun için % 0.1 K2HPO4, % 0.05 MgSO4.7H2O, %0.05 KCI, %1.6 agar su içinde çözündürülüp, 121 ºC de 1.5 atm de 15 dakika otoklavda sterilize edildi. 60 ºC'ye kadar soğuduktan sonra üzerine son konsantrasyonu % 4.8 olacak şekilde distile su ile hazırlanmış ve aynı şartlarda sterilize edilmiş yağsız süttozu çözeltisi aseptik olarak ilave edildi. Bu karışım steril test tüplerine 10'ar ml olarak dağıtılıp, dik olarak donduruldu.
Kültürün enzim üretim yeteneğini test edebilmek için, hazırlanan bu özgün besiyerinin üzerine sıvı stok kültürden 0.1 ml inokule edilerek 26 ºC de 7 güne kadar inkübasyona bırakıldı. Test kültürü proteaz üretebiliyorsa (proteaz pozitif ise), besiyerinde bulunan ve bulanıklığı sağlayan süt kazeinini parçalayarak berraklık oluşturmaktadır. Berraklık oluşmadıysa, kültür kazeini parçalayamadığı için besiyeri berraklaşmamıştır ve negatiftir. Testin değerlendirilmesi; oluşan şeffaflığın derinliği cetvel yardımı ile ölçülerek yapılmıştır. Bu ölçümde 7. günün sonunda 4 mm ve üzerinde ise proteaz yönünden pozitif, 4 mm'nin altında ise negatif olarak değerlendirilmiştir15.
Proteaz Aktivite Tayini
Sıvı Stok Kültürün Hazırlanması: Sabouraud Dextrose Broth(SDB) 100 ml'lik erlenmeyerlere 50 ml üretim ortamı olarak hazırlandı. Dermatofit stok kültürlerinden sıvı SDB besiyerlerine 0.1 ml olarak aşılama yapılarak 30 ºC de 2 hafta süre ile inkübasyona bırakıldı ve sıvı stok kültürler hazırlandı.
Ekim ve Üretim: Sıvı stok kültürden, enzim üretimi için hazırlanan 100 ml'lik SDB besiyerlerine 0.1 ml olarak steril koşullarda ekim yapıldı.
Kültürde Üremenin Ölçülmesi: Kültürde üreme miktarı, hücre kitlesindeki değişmelerin kuru ağırlık olarak (gr/lt cinsinden) ölçülmesiyle belirlendi. Bu amaçla fungus kitlesi önceden kurutulup darası alınarak desikatörde saklanan filtre kağıtlarından (Whatman No:1) süzülerek kültür ortamından ayrıldı. Daha sonra 70 ºC'de 24 saat kurutulup tartıldı. Üreme, gr kuru miçelyum/lt besiyeri olarak hesaplandı16.
Optimum İnkübasyon Sıcaklığının Saptanması: İnkübasyon sıcaklığının enzim aktivitesine etkisini incelemek amacı ile izole ettiğimiz dermatofit stok kültüründen hazırlanmış SDB besiyerine ekim yapıldı. Kültürler 25 ile 60 ºC'de değişen sıcaklıklarda 150 r.p.m. çalkalama hızına ayarlanmış inkübatörde 14 gün süre ile inkübasyona bırakıldı.
Optimum inkübasyon pH'sının Saptanması: Enzim aktivitesine inkübasyon pH'sının etkisini belirlemek amacı ile 4 ile 8 arasında değişen pH aralıklarında hazırlanan SDB besiyerlerine dermatofit örneklerinden ekimler yapıldı. Kültürler 14 gün süre ile 30 ºC'de 150 r.p.m. çalkalama hızına ayarlanmış inkübatörde inkübasyona bırakıldı. İnkübasyon süresi sonunda enzim aktivitesine bakıldı.
Proteaz Miktarının Günlere Göre Değişimi ve Uygun İnkübasyon Süresinin Saptanması
Ekim yapılan besiyerleri yüksek proteaz verimi elde etmek için uygun inkübasyon süresini saptamak amacı ile 30 ºC'de 150 r.p.m. çalkalama hızında 5, 8, 11, 14, 17, 20 ve 23 gün süre ile inkübasyona bırakıldı.
Proteaz Aktivite Tayin Yöntemi: Proteaz aktivite tayininde Kunitz metodunun modifiye edimesi ile oluşan Kazein-Folin yöntemi uygulandı17,18. Proteaz pozitif örneklerden 1ml örnek alınarak 50 ml olarak hazırlanmış SDB besiyerine ekim yapıldı. Üretim, herbir dermatofit türü için 7 kültür hazırlanarak 30 ºC'de, 150 rpm çalkalama hızında 5, 8, 11, 14, 17, 20 ve 23 gün süre ile inkübasyona bırakıldı.
Enzim kaynağı olarak üretim ortamının filtrasyonu ile elde edilen supernatant kullanıldı. Substrat olarak ise 0.1 M fosfat tamponu(pH:6.0) içinde çözünmüş % 1'lik kazein kullanıldı. 1ml enzim ile 1 ml substrat deney tüpünde karıştırılarak 60 dk 30 ºC de inkübasyona bırakıldı. İnkübasyon sonrası reaksiyonu durdurmak için % 10'luk Trikarboksilik asit (TCA) çözeltisinden 3 ml ilave edildi ve vorteksde karıştırılarak 30 dk sonra Whatman I filtre kağıdından süzüldü. Elde edilen filtrattan 1 ml alındı ve 5 ml Lowry C eklendi. Lowry A; 0.1 M NaOH içinde % 2 Na2CO3, Lowry B1; % 1 CuSO4 ve Lowry B2, % 2 sodyum potasyum tartarat hazırlandı. Lowry C ; A:B1:B2 nin sırasıyla 100:1:1 oranında karıştırılması ile elde edildi19.10 dk sonra 1:1 oranında sulandırılmış folin ayıracından 0.5 ml ilave edilerek vorteksde karıştırıldı. Karışım 60 dk oda sıcaklığında reaksiyona bırakıldı, süre sonunda spektrofotometrede 700 nm'de okundu19,20.
Enzim aktivitesi internasyonel ünite (IU) olarak hesaplandı. Bir ünite enzim aktivitesi 1 saatlik inkübasyon süresinde inkübasyon karışımının optik yoğunluğundaki 0.1 birim artışı sağlayan enzim miktarı olarak tanımlandı21.
Dermatofitlerin Kazeinolitik Özelliklerinin İncelenmesi
İzole edilen dermatofit türlerinden T. rubrum ve T. mentagrophytes'in kazeinolitik özelliklerinin incelenmesi için stok kültürlerden süt tozu ilave edilmiş özel hazırlanmış besiyerlerine ekimler yapıldı. Kültürler 2 hafta süre ile 30 ºC'de inkübasyona bırakıldı. İnkübasyon sonrasında fungusun salgıladığı proteaz enzimi kazeni parçalaması sonucu besiyeri renginde açılma meydana geldi. Bu renk açılımının derinliği ölçülerek T. rubrum ve T. mentagrophytes türlerinin kazeinolitik özellikleri değerlendirildi15.
Dermatofitlerin Optimum Üreme ve Enzim Üretim Süresinin Belirlenmesi
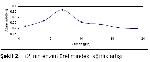
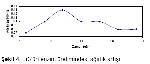
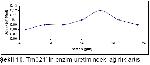
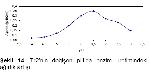
Kazeinolitik özellikleri pozitif olarak değerlendirilen Tr2, Tr3, Tm207, Tr319 ve Tm321 dematofit suşları enzim aktivitesinin incelenmesi için ayrıldı. Her bir dermatofit türü SDB besiyerlerine ekim yapılarak 5, 8, 11, 14, 17, 20 ve 23 gün süre ile inkübasyona bırakıldı. Söz konusu süreler sonunda ağırlık artışı ve enzim aktivitelerine bakıldı. Sonuçlar grafiğe geçirildi.
Enzim Üretiminin Sıcaklığa Göre Ölçülmesi
En yüksek değer elde edilen Tr2 suşu 25 ile 60 ºC arasında değişen sıcaklıklarda 14 gün inkübasyon süresi sonunda enzim aktivitesi ölçüldü