1997'de, SHOX geni, X ve Y kromozomlarının kısa kol bölgelerinin psödootozomal bölgelerinden klonlanmış ve büyümenin düzenlenmesinde aday bir gen olduğu ileri sürülmüştür. SHOX geninin büyümenin düzenlenmesinde rol oynadığının anlaşılmasından sonra LWD'li ve Xp veya Yp delesyonlu hastalarda yapılan pek çok çalışma büyümenin kontrolünde bu genin görev aldığını doğrulamıştır
18,21,24,27. Çalışmamızda konvansiyonel sitogenetik yöntemle değerlendirilen tüm olguların karyotipleri normal olarak değerlendirilmiştir ve bu bulgu idiopatik kısa boylu hastalarda yapılan diğer çalışmalarla uygunluk göstermektedir. Çalışma grubumuz içerisinde normal karyotipe sahip İKB'li hastalardan boyları ortalamanın altında kalan ve en kısa boya sahip olduğu belirlenen 8 bireye uyguladığımız interfaz FISH çalışması sonucunda, 8 bireyden de 2 yeşil sinyal alındı ve bu bireyler normal olarak değerlendirildi. İKB'li hastalarda yapılan diğer çalışmalarda, FISH yöntemi için SHOX genine özgü ve Xp22.3 ile Yp11.3'te lokalize olan LLNOYCO3'M'34F5 kozmid probu kullanılmıştır
18,21,27. Çalışmayı yaptığımız sırada bu prob ticari olarak elde edilebilir olmadığından, SHOX bölgesini de içine alan Xp22 ve Yp11'deki bölgeye spesifik farklı bir prob kullanıldı. İnterfaz FISH metodu uygulanarak elde edilen sonuç, Müsebeck ve arkadaşlarının 35 İKB'li probantta yaptıkları çalışmanın sonucuyla uyumludur
27. Buna karşın, Morizio ve arkadaşlarının 33 dişi ve 23 erkek olmak üzere toplam 56 İKB'li hastada FISH metodu ile yaptıkları araştırma sonucu 4 hastada (%7.1) tek bir SHOX geni kopyasının varlığını tespit etmişlerdir. Bu 4 hastada da SHOX'un bir kopyasının delesyonunun de novo olduğu ve X kromozomunda meydana geldiği ortaya konmuştur
18. Benzer şekilde Binder ve arkadaşları 68 İKB'li hasta çalışmışlar ve yalnızca 1'inde SHOX delesyonu bulmuşlardır
28. Rao ve arkadaşları da İKB'li 91 hastada yaptıkları inceleme sonucu sadece 1 hastada, SHOX geninde bir nokta mutasyon tespit etmişlerdir
24. Diğer bir çalışmada Rappold ve arkadaşları 150 İKB'li hastayı FISH ile incelemişler ve 3'ünde SHOX delesyonuna rastlamışlardır
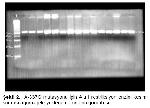
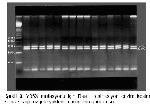
21. A337G ve Y35X mutasyonlarının hasta grubumuzda var olup olmadığı, hastaların PCR ürünlerinin AluI I ve Rsa I restriksiyon enzim kesimiyle araştırıldı. Alu I enzimiyle kontrol edilen hastalar ve kontroller A337G mutasyonu açısından negatif olarak değerlendirildi. Aynı şekilde Y35X mutasyonu Rsa I enzimi ile araştırıldı ve hasta ile kontrollerin tümü bu mutasyon açısından da negatif bulundu.
Rappold ve arkadaşları 2002 yılında 900 İKB'li hastada yaptıkları çalışmada hastaların %2.4'ünde SHOX mutasyonlarını tespit etmişlerdir. Çalışmada A337G mutasyonunu 2 (%0.22) hastada tespit etmişlerdir21. Hasta seçim kriterlerinin farklı olduğu göz önünde bulundurulursa bu mutasyona çalışma grubunda rastlanmaması mümkündür. Daha önce Flanagan ve arkadaşlarının LWD'li hastalarda yapmış oldukları çalışmada tespit ettikleri Y35X mutasyonuna İKB'li 69 bireyde rastlanmamıştır. Bu mutasyon, muhtemelen LWD spesifik olup İKB'ye neden olmamaktadır. Daha önce İKB'li bireylerde yapılan SHOX geni mutasyon tarama çalışmalarında bu mutasyonun İKB'ye neden olduğuna dair bir bulguya rastlanmamıştır. Ancak çalışma sayısı oldukça sınırlıdır. Gendeki aynı mutasyonların İKB veya LWD'ye neden olduğuna dair çalışmalar da mevcuttur. Örneğin R195X mutasyonuna hem LWD'li hem de İKB'li bireylerde rastlanmıştır21. SHOX geninde belirlenen mutasyonların restriksiyon fragment uzunluk polimorfizimi yöntemi ile hem İKB hem de LWD hastalarında taranması her iki hastalığa neden olabilen ortak nokta mutasyonlarının belirlenmesi açısından önemlidir.
Sonuç olarak sitogenetik, moleküler sitogenetik ve moleküler incelemelerimiz sonucunda, İKB'li 69 proband ve 31 kontrol bireyinde herhangi bir anormalliğe rastlanmadı. Çalışmada, SHOX geninin 2. ekzonuna spesifik primerler kullanıldığından sadece bu ekzondaki A-337G ve Y35X olmak üzere iki mutasyonun varlığı araştırılmıştır.20. Oysa SHOX genindeki mutasyonlar tüm gen boyunca dağılım göstermektedir25. Dolayısıyla İKB'li hastaları SHOX gen mutasyonları açısından değerlendirirken, bu gene ait tüm ekzonların incelenmesinin daha doğru sonuçlar vereceği kanaatindeyiz. Bununla beraber İKB'li hastalarda, SHOX'ta görülen mutasyonların prevalansının % 1 olduğu dikkate alındığında24, İKB'li hastalardaki SHOX mutasyonu araştırması için daha fazla sayıda hasta incelemenin daha bilgi verici olacağını düşünmekteyiz.